1. (2023·邵阳)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,至恰好完全反应共消耗氢氧化钠溶液40g(反应的化学方程式为$2NaOH + H_{2}SO_{4} = Na_{2}SO_{4} + 2H_{2}O$)。试计算:
(1)40g氢氧化钠溶液中溶质质量是______g。
(2)这一定量石油产品中含$H_{2}SO_{4}$的质量。(写出计算过程)
(1)
(2)
(1)40g氢氧化钠溶液中溶质质量是______g。
(2)这一定量石油产品中含$H_{2}SO_{4}$的质量。(写出计算过程)
(1)
8
(2)
解:设这一定量石油产品中含${H_{2}SO_{4}}$的质量为$x$。
${2NaOH + H_{2}SO_{4} \xlongequal{} Na_{2}SO_{4} + 2H_{2}O}$
$\begin{array}{ccc}80 & 98 \\8\ \text{g} & x\end{array}$
$\frac{80}{98} = \frac{8\ \text{g}}{x}\quad x = 9.8\ \text{g}$
答:这一定量石油产品中含${H_{2}SO_{4}}$的质量为$9.8\ \text{g}$。
${2NaOH + H_{2}SO_{4} \xlongequal{} Na_{2}SO_{4} + 2H_{2}O}$
$\begin{array}{ccc}80 & 98 \\8\ \text{g} & x\end{array}$
$\frac{80}{98} = \frac{8\ \text{g}}{x}\quad x = 9.8\ \text{g}$
答:这一定量石油产品中含${H_{2}SO_{4}}$的质量为$9.8\ \text{g}$。
答案:(1) 8 (2) 解:设这一定量石油产品中含${H_{2}SO_{4}}$的质量为$x$。
${2NaOH + H_{2}SO_{4} \xlongequal{} Na_{2}SO_{4} + 2H_{2}O}$
$\begin{array}{ccc}80 & 98 \\8\ \text{g} & x\end{array}$
$\frac{80}{98} = \frac{8\ \text{g}}{x}\quad x = 9.8\ \text{g}$
答:这一定量石油产品中含${H_{2}SO_{4}}$的质量为$9.8\ \text{g}$。
解析:(1)$40\ \text{g}$氢氧化钠溶液中溶质质量是$40\ \text{g} × 20\% = 8\ \text{g}$。
${2NaOH + H_{2}SO_{4} \xlongequal{} Na_{2}SO_{4} + 2H_{2}O}$
$\begin{array}{ccc}80 & 98 \\8\ \text{g} & x\end{array}$
$\frac{80}{98} = \frac{8\ \text{g}}{x}\quad x = 9.8\ \text{g}$
答:这一定量石油产品中含${H_{2}SO_{4}}$的质量为$9.8\ \text{g}$。
解析:(1)$40\ \text{g}$氢氧化钠溶液中溶质质量是$40\ \text{g} × 20\% = 8\ \text{g}$。
2. 尿素$[CO(NH_{2})_{2}]$可用于去除大气污染物中的NO,其化学反应为$6NO + 2CO(NH_{2})_{2} = 5N_{2} + 2CO_{2} + 4H_{2}O$。若需去除废气中6gNO,求理论上需溶质质量分数为10%的尿素溶液的质量。
答案:解:设理论上需要溶质质量分数为$10\%$的尿素溶液的质量为$x$。
${6NO + 2CO(NH_{2})_{2} \xlongequal{} 5N_{2} + 2CO_{2} + 4H_{2}O}$
$\begin{array}{ccc}180 & 120 \\6\ \text{g} & 10\% \cdot x\end{array}$
$\frac{180}{120} = \frac{6\ \text{g}}{10\% \cdot x}\quad x = 40\ \text{g}$
答:理论上需要溶质质量分数为$10\%$的尿素溶液的质量是$40\ \text{g}$。
${6NO + 2CO(NH_{2})_{2} \xlongequal{} 5N_{2} + 2CO_{2} + 4H_{2}O}$
$\begin{array}{ccc}180 & 120 \\6\ \text{g} & 10\% \cdot x\end{array}$
$\frac{180}{120} = \frac{6\ \text{g}}{10\% \cdot x}\quad x = 40\ \text{g}$
答:理论上需要溶质质量分数为$10\%$的尿素溶液的质量是$40\ \text{g}$。
3. 某化学兴趣小组的同学进行了如图所示的实验(已知:$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}\uparrow$)。请根据图示信息计算:
(1)实验中产生氢气的质量是
(2)实验中所用稀硫酸中溶质的质量分数。(写出计算过程)
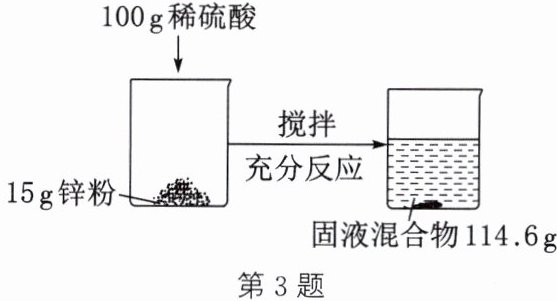
(1)实验中产生氢气的质量是
0.4
g。(2)实验中所用稀硫酸中溶质的质量分数。(写出计算过程)

解:设参加反应的${H_{2}SO_{4}}$的质量为$x$。
${Zn + H_{2}SO_{4} \xlongequal{} ZnSO_{4} + H_{2} \uparrow}$
$\begin{array}{ccc}98 & 2 \\x & 0.4\ \text{g}\end{array}$
$\frac{98}{2} = \frac{x}{0.4\ \text{g}}\quad x = 19.6\ \text{g}$
实验中所用稀硫酸中溶质的质量分数为$\frac{19.6\ \text{g}}{100\ \text{g}} × 100\% = 19.6\%$。
答:实验中所用稀硫酸中溶质的质量分数为$19.6\%$。
${Zn + H_{2}SO_{4} \xlongequal{} ZnSO_{4} + H_{2} \uparrow}$
$\begin{array}{ccc}98 & 2 \\x & 0.4\ \text{g}\end{array}$
$\frac{98}{2} = \frac{x}{0.4\ \text{g}}\quad x = 19.6\ \text{g}$
实验中所用稀硫酸中溶质的质量分数为$\frac{19.6\ \text{g}}{100\ \text{g}} × 100\% = 19.6\%$。
答:实验中所用稀硫酸中溶质的质量分数为$19.6\%$。
答案:(1) $0.4$ (2) 解:设参加反应的${H_{2}SO_{4}}$的质量为$x$。
${Zn + H_{2}SO_{4} \xlongequal{} ZnSO_{4} + H_{2} \uparrow}$
$\begin{array}{ccc}98 & 2 \\x & 0.4\ \text{g}\end{array}$
$\frac{98}{2} = \frac{x}{0.4\ \text{g}}\quad x = 19.6\ \text{g}$
实验中所用稀硫酸中溶质的质量分数为$\frac{19.6\ \text{g}}{100\ \text{g}} × 100\% = 19.6\%$。
答:实验中所用稀硫酸中溶质的质量分数为$19.6\%$。
${Zn + H_{2}SO_{4} \xlongequal{} ZnSO_{4} + H_{2} \uparrow}$
$\begin{array}{ccc}98 & 2 \\x & 0.4\ \text{g}\end{array}$
$\frac{98}{2} = \frac{x}{0.4\ \text{g}}\quad x = 19.6\ \text{g}$
实验中所用稀硫酸中溶质的质量分数为$\frac{19.6\ \text{g}}{100\ \text{g}} × 100\% = 19.6\%$。
答:实验中所用稀硫酸中溶质的质量分数为$19.6\%$。
4. 向100g$CuSO_{4}$溶液中滴加NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量之间的关系如图所示,请依据图中信息回答下列问题:[已知:$CuSO_{4} + 2NaOH = Cu(OH)_{2}\downarrow + Na_{2}SO_{4}$]
(1)该反应生成沉淀的质量为______g。
(2)求$CuSO_{4}$溶液中溶质的质量分数。

(1)
(2)
(1)该反应生成沉淀的质量为______g。
(2)求$CuSO_{4}$溶液中溶质的质量分数。

(1)
4.9
(2)
解:设${CuSO_{4}}$溶液中溶质的质量分数为$x$。
${CuSO_{4} + 2NaOH \xlongequal{} Cu(OH)_{2} \downarrow + Na_{2}SO_{4}}$
$\begin{array}{ccc}160 & 98 \\100\ \text{g} \cdot x & 4.9\ \text{g}\end{array}$
$\frac{160}{98} = \frac{100\ \text{g} \cdot x}{4.9\ \text{g}}\quad x = 8\%$
答:${CuSO_{4}}$溶液中溶质的质量分数为$8\%$。
${CuSO_{4} + 2NaOH \xlongequal{} Cu(OH)_{2} \downarrow + Na_{2}SO_{4}}$
$\begin{array}{ccc}160 & 98 \\100\ \text{g} \cdot x & 4.9\ \text{g}\end{array}$
$\frac{160}{98} = \frac{100\ \text{g} \cdot x}{4.9\ \text{g}}\quad x = 8\%$
答:${CuSO_{4}}$溶液中溶质的质量分数为$8\%$。
答案:(1) $4.9$ (2) 解:设${CuSO_{4}}$溶液中溶质的质量分数为$x$。
${CuSO_{4} + 2NaOH \xlongequal{} Cu(OH)_{2} \downarrow + Na_{2}SO_{4}}$
$\begin{array}{ccc}160 & 98 \\100\ \text{g} \cdot x & 4.9\ \text{g}\end{array}$
$\frac{160}{98} = \frac{100\ \text{g} \cdot x}{4.9\ \text{g}}\quad x = 8\%$
答:${CuSO_{4}}$溶液中溶质的质量分数为$8\%$。
${CuSO_{4} + 2NaOH \xlongequal{} Cu(OH)_{2} \downarrow + Na_{2}SO_{4}}$
$\begin{array}{ccc}160 & 98 \\100\ \text{g} \cdot x & 4.9\ \text{g}\end{array}$
$\frac{160}{98} = \frac{100\ \text{g} \cdot x}{4.9\ \text{g}}\quad x = 8\%$
答:${CuSO_{4}}$溶液中溶质的质量分数为$8\%$。