1. (2024·扬州仪征二模)18世纪末,法国科学家拉瓦锡为探究水的组成,让水蒸气通过一根红热的铁管,发生反应的化学方程式为$3Fe+4H_{2}O(气)\overset{高温}{\xlongequal{\;\;}}Fe_{3}O_{4}+4X$,下列说法不正确的是(
A.X的化学式是$H_{2}$
B.参加反应的Fe和$H_{2}O的质量比为3:4$
C.反应后固体的质量增大
D.该实验证明了“水不是单一元素物质”
B
)A.X的化学式是$H_{2}$
B.参加反应的Fe和$H_{2}O的质量比为3:4$
C.反应后固体的质量增大
D.该实验证明了“水不是单一元素物质”
答案:B
解析:
解:根据质量守恒定律,反应前后原子种类和数目不变。反应前Fe、H、O原子个数分别为3、8、4,反应后已知生成物中Fe、O原子个数分别为3、4,则4X中含有8个H原子,X的化学式为H₂,A正确。
参加反应的Fe和H₂O的质量比为(3×56):(4×18)=168:72=7:3,B错误。
反应前固体为Fe,反应后生成Fe₃O₄,氧元素加入,固体质量增大,C正确。
该反应生成H₂和Fe₃O₄,证明水由氢、氧元素组成,不是单一元素物质,D正确。
答案:B
参加反应的Fe和H₂O的质量比为(3×56):(4×18)=168:72=7:3,B错误。
反应前固体为Fe,反应后生成Fe₃O₄,氧元素加入,固体质量增大,C正确。
该反应生成H₂和Fe₃O₄,证明水由氢、氧元素组成,不是单一元素物质,D正确。
答案:B
2. (2024·滨州)密闭容器内有甲、乙、丙、丁四种物质,在一定条件下发生某一化学反应,反应前后各物质质量如图所示。下列说法不正确的是(
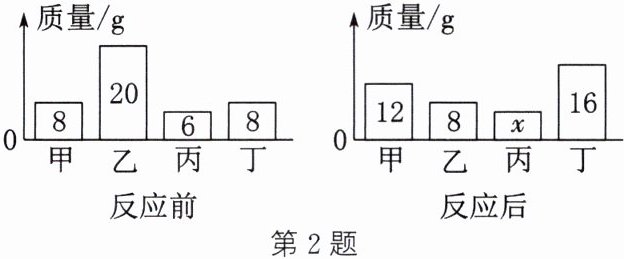
A.该反应遵循质量守恒定律
B.丙可能为该反应的催化剂
C.反应前后乙和丁的质量变化之比为$3:2$
D.甲和丁的相对分子质量之比为$1:2$
D
)
A.该反应遵循质量守恒定律
B.丙可能为该反应的催化剂
C.反应前后乙和丁的质量变化之比为$3:2$
D.甲和丁的相对分子质量之比为$1:2$
答案:D 解析:对甲、乙、丙、丁四种物质的质量在反应前后的变化分析如下:
|物质|甲|乙|丙|丁|
|----|----|----|----|----|
|反应前质量/g|8|20|6|8|
|反应后质量/g|12|8|6|16|
|质量变化|增加4g|减少12g|不变|增加8g|
化学反应均遵循质量守恒定律,A正确。分析反应前后四种物质的质量变化,丙物质的质量在反应前后不变,可能是该反应的催化剂,也可能是与反应无关的物质,B正确。反应前后乙、丁两种物质的质量变化之比为12g:8g=3:2,C正确。以上分析只能得到反应生成的甲、丁的质量之比,若要计算两种物质的相对分子质量之比,还需要知道两种物质的化学计量数之比,D错误。故本题选D。
|物质|甲|乙|丙|丁|
|----|----|----|----|----|
|反应前质量/g|8|20|6|8|
|反应后质量/g|12|8|6|16|
|质量变化|增加4g|减少12g|不变|增加8g|
化学反应均遵循质量守恒定律,A正确。分析反应前后四种物质的质量变化,丙物质的质量在反应前后不变,可能是该反应的催化剂,也可能是与反应无关的物质,B正确。反应前后乙、丁两种物质的质量变化之比为12g:8g=3:2,C正确。以上分析只能得到反应生成的甲、丁的质量之比,若要计算两种物质的相对分子质量之比,还需要知道两种物质的化学计量数之比,D错误。故本题选D。
3. (2023·吉林)化学兴趣小组的同学用气密性良好的不同装置进行如图所示的三个实验,验证质量守恒定律。(已知:碳酸钠的化学性质与碳酸钙相似)

(1)实验一:开始实验前称得装置和试剂的总质量为$m_{1}$且保持装置密闭;使红磷燃烧,待装置冷却后,称得装置和试剂的总质量为$m_{2}$。$m_{1}与m_{2}的大小关系是m_{1}$
(2)实验二:将气球中的碳酸钠粉末倒入锥形瓶中,观察到的现象是
(3)为克服实验二中受到的气球浮力的影响,在实验三中利用硬塑料瓶改进实验装置,用电子天平称量装置和试剂的总质量,接下来的实验操作是
(4)化学反应遵循质量守恒定律,其微观原因是

(1)实验一:开始实验前称得装置和试剂的总质量为$m_{1}$且保持装置密闭;使红磷燃烧,待装置冷却后,称得装置和试剂的总质量为$m_{2}$。$m_{1}与m_{2}的大小关系是m_{1}$
=
$m_{2}$。(2)实验二:将气球中的碳酸钠粉末倒入锥形瓶中,观察到的现象是
有气泡产生,气球膨胀,电子天平的示数减小
。(3)为克服实验二中受到的气球浮力的影响,在实验三中利用硬塑料瓶改进实验装置,用电子天平称量装置和试剂的总质量,接下来的实验操作是
翻转硬塑料瓶,使稀盐酸和碳酸钠粉末充分接触
,待反应结束后,再次称量装置和试剂的总质量,电子天平示数不变。(4)化学反应遵循质量守恒定律,其微观原因是
化学反应前后,原子种类、个数和质量都不变
。答案:(1)= (2)有气泡产生,气球膨胀,电子天平的示数减小 (3)翻转硬塑料瓶,使稀盐酸和碳酸钠粉末充分接触 (4)化学反应前后,原子种类、个数和质量都不变
4. (2023·天津)在反应$C+2ZnO\overset{高温}{\xlongequal{\;\;}}2Zn+CO_{2}\uparrow$中,下列有关说法正确的是(
A.反应前后各元素的化合价均无变化
B.反应前后锌元素的质量没有发生改变
C.参加反应的碳与氧化锌的质量比为$4:27$
D.反应后固体总质量减小,不遵循质量守恒定律
B
)A.反应前后各元素的化合价均无变化
B.反应前后锌元素的质量没有发生改变
C.参加反应的碳与氧化锌的质量比为$4:27$
D.反应后固体总质量减小,不遵循质量守恒定律
答案:B
解析:
解:
A. 反应中碳元素化合价由0变为+4,锌元素化合价由+2变为0,氧元素化合价不变,A错误;
B. 依据质量守恒定律,反应前后锌元素质量不变,B正确;
C. 参加反应的碳与氧化锌的质量比为12:(2×81)=2:27,C错误;
D. 反应后生成二氧化碳气体逸出,固体总质量减小,但遵循质量守恒定律,D错误。
结论:B
A. 反应中碳元素化合价由0变为+4,锌元素化合价由+2变为0,氧元素化合价不变,A错误;
B. 依据质量守恒定律,反应前后锌元素质量不变,B正确;
C. 参加反应的碳与氧化锌的质量比为12:(2×81)=2:27,C错误;
D. 反应后生成二氧化碳气体逸出,固体总质量减小,但遵循质量守恒定律,D错误。
结论:B
5. 写出下列化学方程式。
(1)“打铁花”就是将生铁熔化后的铁水打向空中,形成铁花。请用化学方程式表示其中的主要原理:
(2)镁在空气中燃烧产生明亮的光,可用于制作烟花或照明弹。请写出镁在空气(氧气)中反应的化学方程式:
(3)硫酸铜溶液滴入氢氧化钠溶液中生成氢氧化铜沉淀和硫酸钠溶液:
(1)“打铁花”就是将生铁熔化后的铁水打向空中,形成铁花。请用化学方程式表示其中的主要原理:
$3Fe+2O_{2}\xlongequal {点燃}Fe_{3}O_{4}$
。(2)镁在空气中燃烧产生明亮的光,可用于制作烟花或照明弹。请写出镁在空气(氧气)中反应的化学方程式:
$2Mg+O_{2}\xlongequal {点燃}2MgO$
。(3)硫酸铜溶液滴入氢氧化钠溶液中生成氢氧化铜沉淀和硫酸钠溶液:
$CuSO_{4}+2NaOH=Cu(OH)_{2}\downarrow +Na_{2}SO_{4}$
。答案:(1)$3Fe+2O_{2}\xlongequal {点燃}Fe_{3}O_{4}$ (2)$2Mg+O_{2}\xlongequal {点燃}2MgO$ (3)$CuSO_{4}+2NaOH=Cu(OH)_{2}\downarrow +Na_{2}SO_{4}$