1. 下列变化能用质量守恒定律解释的是 (
A.高锰酸钾加热后剩余固体质量比反应前小
B.水的质量和受热变成水蒸气的质量相等
C.1g 食盐溶解到 10g 水中得到 11g 食盐水
D.1L 植物油倒入 1L 水后体积变为 2L
A
)A.高锰酸钾加热后剩余固体质量比反应前小
B.水的质量和受热变成水蒸气的质量相等
C.1g 食盐溶解到 10g 水中得到 11g 食盐水
D.1L 植物油倒入 1L 水后体积变为 2L
答案:A
2. 孔雀石的主要成分是碱式碳酸铜[Cu₂(OH)₂CO₃],受热易分解。下列物质不可能是其分解产物的是 (
A.H₂O
B.CuO
C.CO₂
D.NO₂
D
)A.H₂O
B.CuO
C.CO₂
D.NO₂
答案:D
解析:
解:根据质量守恒定律,化学反应前后元素种类不变。碱式碳酸铜[Cu₂(OH)₂CO₃]中含有铜(Cu)、氧(O)、氢(H)、碳(C)四种元素,不含氮(N)元素。
A.H₂O含H、O元素,可能是分解产物;
B.CuO含Cu、O元素,可能是分解产物;
C.CO₂含C、O元素,可能是分解产物;
D.NO₂含N、O元素,因反应物不含N元素,不可能是分解产物。
结论:D
A.H₂O含H、O元素,可能是分解产物;
B.CuO含Cu、O元素,可能是分解产物;
C.CO₂含C、O元素,可能是分解产物;
D.NO₂含N、O元素,因反应物不含N元素,不可能是分解产物。
结论:D
3. 下列关于$ 2CO+O₂\xlongequal{点燃}2CO₂ $的说法中,正确的是 (
A.参加反应的一氧化碳与氧气的质量比为 2:1
B.反应前后分子、原子的个数均保持不变
C.表示一氧化碳加氧气等于二氧化碳
D.表示一氧化碳与氧气在点燃的条件下反应生成二氧化碳
D
)A.参加反应的一氧化碳与氧气的质量比为 2:1
B.反应前后分子、原子的个数均保持不变
C.表示一氧化碳加氧气等于二氧化碳
D.表示一氧化碳与氧气在点燃的条件下反应生成二氧化碳
答案:D
解析:
解:A. 参加反应的一氧化碳与氧气的质量比为(28×2):32=7:4,A错误;
B. 反应前分子个数为3,反应后分子个数为2,分子个数改变,B错误;
C. “+”应表示“和”,“=”应表示“生成”,C错误;
D. 表示一氧化碳与氧气在点燃的条件下反应生成二氧化碳,D正确。
结论:D
B. 反应前分子个数为3,反应后分子个数为2,分子个数改变,B错误;
C. “+”应表示“和”,“=”应表示“生成”,C错误;
D. 表示一氧化碳与氧气在点燃的条件下反应生成二氧化碳,D正确。
结论:D
4. 下列化学方程式与客观事实相符,且书写完全正确的是 (
A.加热氧化汞粉末$:2HgO\xlongequal{\triangle }Hg+O₂↑$
B.$铁丝在氧气中燃烧$:4Fe+3O₂\xlongequal{点燃}2Fe₂O₃
C.$镁条在氧气中燃烧$:2Mg+O₂\xlongequal{\;}2MgO
D.硫酸铜溶液与氢氧化钠溶液反应$:CuSO₄+2NaOH\xlongequal{\;}Na₂SO₄+Cu(OH)₂↓$
D
)A.加热氧化汞粉末$:2HgO\xlongequal{\triangle }Hg+O₂↑$
B.$铁丝在氧气中燃烧$:4Fe+3O₂\xlongequal{点燃}2Fe₂O₃
C.$镁条在氧气中燃烧$:2Mg+O₂\xlongequal{\;}2MgO
D.硫酸铜溶液与氢氧化钠溶液反应$:CuSO₄+2NaOH\xlongequal{\;}Na₂SO₄+Cu(OH)₂↓$
答案:D
解析:
A. 化学方程式未配平,正确应为$2HgO\xlongequal{\triangle }2Hg+O₂↑$,故A错误;
B. 铁丝在氧气中燃烧生成四氧化三铁,正确化学方程式为$3Fe+2O₂\xlongequal{点燃}Fe₃O₄$,故B错误;
C. 未注明反应条件“点燃”,正确应为$2Mg+O₂\xlongequal{点燃}2MgO$,故C错误;
D. 化学方程式与客观事实相符,书写完全正确,故D正确。
答案:D
B. 铁丝在氧气中燃烧生成四氧化三铁,正确化学方程式为$3Fe+2O₂\xlongequal{点燃}Fe₃O₄$,故B错误;
C. 未注明反应条件“点燃”,正确应为$2Mg+O₂\xlongequal{点燃}2MgO$,故C错误;
D. 化学方程式与客观事实相符,书写完全正确,故D正确。
答案:D
5. 构建化学基本观念是学好化学的基础,下列对化学基本观念认识错误的是 (
A.元素观:二氧化碳是由碳元素和氧元素组成的
B.微粒观:保持氧气化学性质的最小微观粒子是氧分子
C.变化观:氢气在空气中燃烧生成水
D.守恒观:24g 镁和 32g 氧气充分反应,生成 56g 氧化镁
D
)A.元素观:二氧化碳是由碳元素和氧元素组成的
B.微粒观:保持氧气化学性质的最小微观粒子是氧分子
C.变化观:氢气在空气中燃烧生成水
D.守恒观:24g 镁和 32g 氧气充分反应,生成 56g 氧化镁
答案:D
解析:
解:D选项中,镁和氧气反应的化学方程式为:$2{Mg} + {O_2}\xlongequal{点燃}2{MgO}$。
参加反应的镁、氧气与生成的氧化镁的质量比为$(24×2):32:(40×2)=48:32:80$。
24g镁完全反应需氧气质量为$24{g}×\frac{32}{48}=16{g}$,生成氧化镁质量为$24{g}+16{g}=40{g}$,氧气有剩余,不能生成56g氧化镁,故D错误。
答案:D
参加反应的镁、氧气与生成的氧化镁的质量比为$(24×2):32:(40×2)=48:32:80$。
24g镁完全反应需氧气质量为$24{g}×\frac{32}{48}=16{g}$,生成氧化镁质量为$24{g}+16{g}=40{g}$,氧气有剩余,不能生成56g氧化镁,故D错误。
答案:D
6. 镁条在空气中燃烧时,不仅与氧气发生反应生成氧化镁,也会与氮气发生反应生成氮化镁(Mg₃N₂)。将 22.2g 镁条在盛有足量空气的密闭容器中点燃,镁条完全反应,经检测有 10g 氧化镁生成,则容器中氮气减少的质量是 (
A.5g
B.4.36g
C.6.3g
D.5.6g
C
)A.5g
B.4.36g
C.6.3g
D.5.6g
答案:C 解析:设有 10 g 氧化镁生成时,参加反应的镁的质量为 x。
$2Mg+{O}_{2}\xlongequal{点燃}2MgO$
$\frac {48}{80}=\frac {x}{10g}$
$x=6g$
因此与氮气反应的镁的质量为$22.2g-6g=16.2g$。设参加反应的氮气的质量为 y。
$3Mg+{N}_{2}\xlongequal{点燃}M{g}_{3}{N}_{2}$
$\frac {72}{28}=\frac {16.2g}{y}$
$y=6.3g$
容器中氮气减少的质量是 6.3 g。故本题选 C。
$2Mg+{O}_{2}\xlongequal{点燃}2MgO$
$\frac {48}{80}=\frac {x}{10g}$
$x=6g$
因此与氮气反应的镁的质量为$22.2g-6g=16.2g$。设参加反应的氮气的质量为 y。
$3Mg+{N}_{2}\xlongequal{点燃}M{g}_{3}{N}_{2}$
$\frac {72}{28}=\frac {16.2g}{y}$
$y=6.3g$
容器中氮气减少的质量是 6.3 g。故本题选 C。
7. 相同质量的碳酸镁和碳酸氢钠分别与足量的盐酸反应,下列有关说法正确的是(已知:发生反应的化学方程式分别为$ MgCO₃+2HCl\xlongequal{\;}MgCl₂+H₂O+CO₂↑、$$NaHCO₃+HCl\xlongequal{\;}NaCl+H₂O+CO₂↑) (
B. 碳酸镁消耗的氯化氢少
C. 生成的二氧化碳一样多
D. 碳酸氢钠生成的二氧化碳少
C
)A. $消耗的氯化氢一样多B. 碳酸镁消耗的氯化氢少
C. 生成的二氧化碳一样多
D. 碳酸氢钠生成的二氧化碳少
答案:C
解析:
解:设碳酸镁和碳酸氢钠的质量均为m。
1. 消耗氯化氢的质量:
碳酸镁与盐酸反应:$MgCO₃+2HCl=MgCl₂+H₂O+CO₂↑$
84($MgCO₃$相对分子质量)对应73(2HCl相对分子质量),
消耗HCl质量:$\frac{73m}{84}$。
碳酸氢钠与盐酸反应:$NaHCO₃+HCl=NaCl+H₂O+CO₂↑$
84($NaHCO₃$相对分子质量)对应36.5(HCl相对分子质量),
消耗HCl质量:$\frac{36.5m}{84}$。
因$\frac{73m}{84}>\frac{36.5m}{84}$,故碳酸镁消耗HCl更多,A、B错误。
2. 生成二氧化碳的质量:
两反应中,$MgCO₃$和$NaHCO₃$的相对分子质量均为84,且均生成1个$CO₂$分子,
生成$CO₂$质量均为:$\frac{44m}{84}$。
故生成的$CO₂$一样多,C正确,D错误。
结论:C
1. 消耗氯化氢的质量:
碳酸镁与盐酸反应:$MgCO₃+2HCl=MgCl₂+H₂O+CO₂↑$
84($MgCO₃$相对分子质量)对应73(2HCl相对分子质量),
消耗HCl质量:$\frac{73m}{84}$。
碳酸氢钠与盐酸反应:$NaHCO₃+HCl=NaCl+H₂O+CO₂↑$
84($NaHCO₃$相对分子质量)对应36.5(HCl相对分子质量),
消耗HCl质量:$\frac{36.5m}{84}$。
因$\frac{73m}{84}>\frac{36.5m}{84}$,故碳酸镁消耗HCl更多,A、B错误。
2. 生成二氧化碳的质量:
两反应中,$MgCO₃$和$NaHCO₃$的相对分子质量均为84,且均生成1个$CO₂$分子,
生成$CO₂$质量均为:$\frac{44m}{84}$。
故生成的$CO₂$一样多,C正确,D错误。
结论:C
8. 某化学反应的微观模拟示意图如图,下列说法错误的是 (
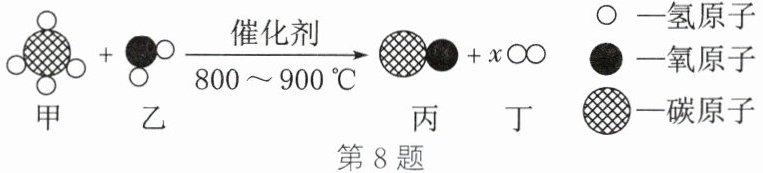
A.图示中 x 的数值为 3
B.该反应前后原子种类、数目、质量均不发生改变
C.反应前后氢元素的化合价发生了改变
D.反应中甲、丙两种物质的质量变化比为 2:7
D
)
A.图示中 x 的数值为 3
B.该反应前后原子种类、数目、质量均不发生改变
C.反应前后氢元素的化合价发生了改变
D.反应中甲、丙两种物质的质量变化比为 2:7
答案:D 解析:由反应的微观示意图可知,该反应的化学方程式为$C{H}_{4}+{H}_{2}O\xlongequal[800\sim 900{\hspace{0pt}}^{\circ }C]{催化剂}CO+3{H}_{2}$。根据化学反应前后原子的种类和个数都不变,可知生成氢分子的个数是 3,因此$x=3$,A 正确;由质量守恒定律可知,反应前后原子种类、数目、质量均不发生改变,B 正确;有单质参加或有单质生成的反应一定有元素的化合价发生改变,反应前后氢元素的化合价由+1 变成 0,C 正确;反应中甲烷分子和一氧化碳分子的个数比是$1:1$,因此质量变化比为$16:28=4:7$,D 错误。故本题选 D。