1. 化学式中
各原子的相对原子质量的总和
称为化学式量。对于由分子构成的物质,其化学式量也叫相对分子质量。化学式量= 化学式中各元素的相对原子质量
×原子个数
之和。答案:各原子的相对原子质量的总和 相对原子质量 原子个数
2. 组成物质的各元素的质量比就是
相对原子质量与原子个数
的乘积之比,即各元素原子的相对原子质量和之比,计算结果一般用最简整数比表示。答案:相对原子质量与原子个数
解析:
组成物质的各元素的质量比就是相对原子质量与原子个数的乘积之比,即各元素原子的相对原子质量和之比,计算结果一般用最简整数比表示。
3. 物质中某元素的质量分数就是
该元素的质量与组成物质的各元素质量总和
之比,其计算公式为物质中某元素的质量分数=$\frac{该元素的相对原子质量 × 原子个数}{该物质的化学式量} × 100\%$
。答案:该元素的质量与组成物质的各元素质量总和 $\frac{该元素的相对原子质量 × 原子个数}{该物质的化学式量} × 100\%$
4. 化合物中某元素的质量= 化合物的质量×
该元素的质量分数
。答案:该元素的质量分数
解析:
化合物中某元素的质量= 化合物的质量×该元素的质量分数
1. 已知同温、同压下,气体的化学式量越小,密度越小。下列气体中密度最小的是 (
$A. N_2$
$B. CO$
$C. SO_2$
$D. CH_4$
D
)$A. N_2$
$B. CO$
$C. SO_2$
$D. CH_4$
答案:D
解析:
解:计算各气体的化学式量:
A. $N_2$:$14×2 = 28$
B. CO:$12 + 16 = 28$
C. $SO_2$:$32 + 16×2 = 64$
D. $CH_4$:$12 + 1×4 = 16$
同温同压下,气体化学式量越小,密度越小。$16<28<64$,故密度最小的是$CH_4$。
答案:D
A. $N_2$:$14×2 = 28$
B. CO:$12 + 16 = 28$
C. $SO_2$:$32 + 16×2 = 64$
D. $CH_4$:$12 + 1×4 = 16$
同温同压下,气体化学式量越小,密度越小。$16<28<64$,故密度最小的是$CH_4$。
答案:D
2. 燃放爆竹产生一种污染物,其元素质量比为1:1,该污染物为 (
$A.SO_2$
$B.H_2S$
$C.CO$
$D.NO_2$
A
)$A.SO_2$
$B.H_2S$
$C.CO$
$D.NO_2$
答案:A
解析:
解:计算各选项中元素质量比:
A. $SO_2$:$S:O = 32:(16×2) = 32:32 = 1:1$
B. $H_2S$:$H:S = (1×2):32 = 2:32 = 1:16$
C. $CO$:$C:O = 12:16 = 3:4$
D. $NO_2$:$N:O = 14:(16×2) = 14:32 = 7:16$
答案:A
A. $SO_2$:$S:O = 32:(16×2) = 32:32 = 1:1$
B. $H_2S$:$H:S = (1×2):32 = 2:32 = 1:16$
C. $CO$:$C:O = 12:16 = 3:4$
D. $NO_2$:$N:O = 14:(16×2) = 14:32 = 7:16$
答案:A
3. (2024·盐城东台期中)下列有关物质所含氧元素的质量分数最大的是 (
A.FeO
B.Fe_2O_3$$
C.Fe_3O_4$$
$D.H_2O$
D
)A.FeO
B.Fe_2O_3$$
C.Fe_3O_4$$
$D.H_2O$
答案:D
解析:
解:分别计算各物质中氧元素的质量分数:
A. FeO中氧元素质量分数:$\frac{16}{56+16} × 100\% \approx 22.2\%$
B. $Fe_2O_3$中氧元素质量分数:$\frac{16×3}{56×2+16×3} × 100\% = 30\%$
C. $Fe_3O_4$中氧元素质量分数:$\frac{16×4}{56×3+16×4} × 100\% \approx 27.6\%$
D. $H_2O$中氧元素质量分数:$\frac{16}{1×2+16} × 100\% \approx 88.9\%$
比较可知,氧元素质量分数最大的是$H_2O$。
答案:D
A. FeO中氧元素质量分数:$\frac{16}{56+16} × 100\% \approx 22.2\%$
B. $Fe_2O_3$中氧元素质量分数:$\frac{16×3}{56×2+16×3} × 100\% = 30\%$
C. $Fe_3O_4$中氧元素质量分数:$\frac{16×4}{56×3+16×4} × 100\% \approx 27.6\%$
D. $H_2O$中氧元素质量分数:$\frac{16}{1×2+16} × 100\% \approx 88.9\%$
比较可知,氧元素质量分数最大的是$H_2O$。
答案:D
4. (2025·宿迁沭阳段考)高锰酸钾$(KMnO_4)$是生活中常用的消毒剂,下列关于高锰酸钾的说法正确的是 (
A.高锰酸钾中锰元素的化合价为+6
B.高锰酸钾中含4个氧原子
C.高锰酸钾由4种元素组成
D.高锰酸钾中氧元素质量分数最大
D
)A.高锰酸钾中锰元素的化合价为+6
B.高锰酸钾中含4个氧原子
C.高锰酸钾由4种元素组成
D.高锰酸钾中氧元素质量分数最大
答案:D
解析:
解:A. 设锰元素化合价为x,(+1)+x+(-2)×4=0,x=+7,A错误。
B. 一个KMnO₄分子含4个氧原子,B错误。
C. KMnO₄由K、Mn、O三种元素组成,C错误。
D. K:39,Mn:55,O:16×4=64,氧元素质量分数最大,D正确。
答案:D
B. 一个KMnO₄分子含4个氧原子,B错误。
C. KMnO₄由K、Mn、O三种元素组成,C错误。
D. K:39,Mn:55,O:16×4=64,氧元素质量分数最大,D正确。
答案:D
5. (2024·无锡模拟)如图是氨气$(NH_3)$的分子模型,下列关于氨气的说法正确的是(
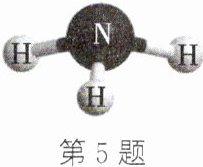
A.氨气是无色、无味的气体
B.氨气中氮元素的化合价为-3
C.氮元素与氢元素的质量比为1:3
D.氨气中氢元素的质量分数为$\frac{1}{17}×100%≈5.9%$
B
)
A.氨气是无色、无味的气体
B.氨气中氮元素的化合价为-3
C.氮元素与氢元素的质量比为1:3
D.氨气中氢元素的质量分数为$\frac{1}{17}×100%≈5.9%$
答案:B
解析:
解:A.氨气有刺激性气味,A错误;
B.氨气中氢元素化合价为+1,设氮元素化合价为x,x+3×(+1)=0,x=-3,B正确;
C.氮元素与氢元素质量比为14:(1×3)=14:3,C错误;
D.氢元素质量分数为(1×3)/(14+1×3)×100%=3/17×100%≈17.6%,D错误。
答案:B
B.氨气中氢元素化合价为+1,设氮元素化合价为x,x+3×(+1)=0,x=-3,B正确;
C.氮元素与氢元素质量比为14:(1×3)=14:3,C错误;
D.氢元素质量分数为(1×3)/(14+1×3)×100%=3/17×100%≈17.6%,D错误。
答案:B
6. (2025·宿迁段考)脱氢乙酸钠$(C_8H_7NaO_4)$可用作防腐剂、防腐杀虫剂,2025年2月8日正式实施的《食品安全国家标准—食品添加剂使用标准》(GB2760-2024)中删除了脱氢乙酸钠在淀粉制品、面包、糕点、焙烤食品馅料等食品中的使用。
(1) 脱氢乙酸钠中共有
(2) 脱氢乙酸钠的化学式量为
(3) 脱氢乙酸钠中碳、氢原子的个数比为
(4) 脱氢乙酸钠中碳、氧元素的质量比为
(5) 脱氢乙酸钠中碳元素的质量分数为
(6) 190g脱氢乙酸钠中含氧元素的质量为
(1) 脱氢乙酸钠中共有
四
种元素。(2) 脱氢乙酸钠的化学式量为
190
。(3) 脱氢乙酸钠中碳、氢原子的个数比为
$8:7$
。(4) 脱氢乙酸钠中碳、氧元素的质量比为
$3:2$
。(5) 脱氢乙酸钠中碳元素的质量分数为
$50.5\%$
(结果精确到0.1%)。(6) 190g脱氢乙酸钠中含氧元素的质量为
64
g。答案:(1) 四 (2) 190 (3) $8:7$ (4) $3:2$ (5) $50.5\%$ (6) 64 解析: 由脱氢乙酸钠 $(C_{8}H_{7}NaO_{4})$ 化学式可知: (1) 脱氢乙酸钠中共有碳、氢、钠、氧四种元素。(2) 脱氢乙酸钠的化学式量为 $12 × 8 + 1 × 7 + 23 + 16 × 4 = 190$。(3) 脱氢乙酸钠中碳、氢原子的个数比为 $8:7$。(4) 脱氢乙酸钠中碳、氧元素的质量比为 $(12 × 8):(16 × 4) = 3:2$。(5) 脱氢乙酸钠中碳元素的质量分数为 $\frac{12 × 8}{190} × 100\% \approx 50.5\%$。(6) $190g$ 脱氢乙酸钠中含氧元素的质量为 $190g × (\frac{16 × 4}{190} × 100\%) = 64g$。
解析:
(1) 四
(2) 190
(3) $8:7$
(4) $3:2$
(5) $50.5\%$
(6) 64
(2) 190
(3) $8:7$
(4) $3:2$
(5) $50.5\%$
(6) 64