14. 选择符合下列要求的概念,并用其序号填空。
①原子 ②分子 ③离子 ④电子 ⑤核电荷数 ⑥元素
(1) 1897年,英国科学家汤姆孙通过实验确认了
(2) 元素是具有相同
(3) 1803年,英国科学家道尔顿提出了
(4) 氧气和氮气的
①原子 ②分子 ③离子 ④电子 ⑤核电荷数 ⑥元素
(1) 1897年,英国科学家汤姆孙通过实验确认了
④
的存在。(2) 元素是具有相同
⑤
的同一类原子的总称。(3) 1803年,英国科学家道尔顿提出了
①
学说。(4) 氧气和氮气的
⑥
组成不同,其化学性质不同;一氧化碳和二氧化碳的②
构成不同,其化学性质不同。答案:【解析】:
(1) 1897年,英国科学家汤姆孙通过实验发现了电子,这是他对阴极射线的研究成果。
【答案】:④
(2) 元素是具有相同核电荷数(即质子数)的同一类原子的总称。这是化学元素的基本定义。
【答案】:⑤
(3) 1803年,英国科学家道尔顿提出了原子学说,他认为物质是由不可分割的原子构成的。
【答案】:①
(4) 氧气和氮气是由不同的元素组成的,具体来说是氧元素和氮元素,这决定了它们的化学性质。而一氧化碳和二氧化碳虽然都包含碳元素和氧元素,但它们的分子构成不同(一个是一氧化碳分子$CO$,另一个是二氧化碳分子$CO_2$),这也导致了它们化学性质的差异。
【答案】:⑥;②
【答案】:
(1) ④
(2) ⑤
(3) ①
(4) ⑥;②
(1) 1897年,英国科学家汤姆孙通过实验发现了电子,这是他对阴极射线的研究成果。
【答案】:④
(2) 元素是具有相同核电荷数(即质子数)的同一类原子的总称。这是化学元素的基本定义。
【答案】:⑤
(3) 1803年,英国科学家道尔顿提出了原子学说,他认为物质是由不可分割的原子构成的。
【答案】:①
(4) 氧气和氮气是由不同的元素组成的,具体来说是氧元素和氮元素,这决定了它们的化学性质。而一氧化碳和二氧化碳虽然都包含碳元素和氧元素,但它们的分子构成不同(一个是一氧化碳分子$CO$,另一个是二氧化碳分子$CO_2$),这也导致了它们化学性质的差异。
【答案】:⑥;②
【答案】:
(1) ④
(2) ⑤
(3) ①
(4) ⑥;②
15. 走进化学变化的微观世界,在“宏观—微观—符号”之间建立联系,有利于我们进一步认识化学变化。下图是某化学变化的微观示意图,根据图示回答问题。
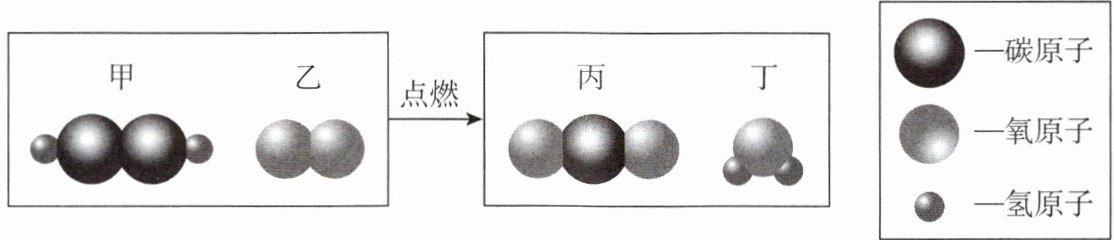
(1) 甲、乙、丙、丁四种物质中,属于氧化物的有
(2) 甲物质中碳、氢元素的质量比为
(3) 参加反应的甲物质与反应生成的丙物质中碳元素质量
(4) 该反应前后分子的数目
(5) 写出该反应的化学方程式:

(1) 甲、乙、丙、丁四种物质中,属于氧化物的有
2
种。(2) 甲物质中碳、氢元素的质量比为
4:1
。(3) 参加反应的甲物质与反应生成的丙物质中碳元素质量
相等
(选填“相等”或“不相等”)。(4) 该反应前后分子的数目
有
(选填“有”或“没有”)发生变化。(5) 写出该反应的化学方程式:
$C_{2}H_{6}O + 3O_{2}\stackrel{点燃}{=\!=\!=}2CO_{2} + 3H_{2}O$
。答案:【解析】:
(1)氧化物是由两种元素组成,其中一种元素是氧元素的化合物,根据微观示意图,甲的化学式为$C_{2}H_{6}O$,乙的化学式为$O_{2}$,丙的化学式为$CO_{2}$,丁的化学式为$H_{2}O$,所以属于氧化物的是丙($CO_{2}$)和丁($H_{2}O$),共2种。
(2)甲物质($C_{2}H_{6}O$)中碳、氢元素的质量比为$(12×2):(1×6)=4:1$。
(3)根据质量守恒定律,化学反应前后元素的质量不变,甲物质中的碳元素全部转化到丙物质中,所以参加反应的甲物质与反应生成的丙物质中碳元素质量相等。
(4)由微观示意图可知,反应前有2个甲分子和1个乙分子,共3个分子;反应后有2个丙分子和3个丁分子,共5个分子,所以该反应前后分子的数目有发生变化。
(5)该反应是$C_{2}H_{6}O$和$O_{2}$在点燃的条件下反应生成$CO_{2}$和$H_{2}O$,化学方程式为$C_{2}H_{6}O + 3O_{2}\stackrel{点燃}{=\!=\!=}2CO_{2} + 3H_{2}O$。
【答案】:
(1) 2
(2) $4:1$
(3) 相等
(4) 有
(5) $C_{2}H_{6}O + 3O_{2}\stackrel{点燃}{=\!=\!=}2CO_{2} + 3H_{2}O$
(1)氧化物是由两种元素组成,其中一种元素是氧元素的化合物,根据微观示意图,甲的化学式为$C_{2}H_{6}O$,乙的化学式为$O_{2}$,丙的化学式为$CO_{2}$,丁的化学式为$H_{2}O$,所以属于氧化物的是丙($CO_{2}$)和丁($H_{2}O$),共2种。
(2)甲物质($C_{2}H_{6}O$)中碳、氢元素的质量比为$(12×2):(1×6)=4:1$。
(3)根据质量守恒定律,化学反应前后元素的质量不变,甲物质中的碳元素全部转化到丙物质中,所以参加反应的甲物质与反应生成的丙物质中碳元素质量相等。
(4)由微观示意图可知,反应前有2个甲分子和1个乙分子,共3个分子;反应后有2个丙分子和3个丁分子,共5个分子,所以该反应前后分子的数目有发生变化。
(5)该反应是$C_{2}H_{6}O$和$O_{2}$在点燃的条件下反应生成$CO_{2}$和$H_{2}O$,化学方程式为$C_{2}H_{6}O + 3O_{2}\stackrel{点燃}{=\!=\!=}2CO_{2} + 3H_{2}O$。
【答案】:
(1) 2
(2) $4:1$
(3) 相等
(4) 有
(5) $C_{2}H_{6}O + 3O_{2}\stackrel{点燃}{=\!=\!=}2CO_{2} + 3H_{2}O$
16. 秋葵富含维生素A($C_{20}H_{30}O$)、胡萝卜素($C_{40}H_{56}$)、纤维素$[(C_6H_{10}O_5)_n]$和蛋白质等物质,另含有丰富的铁、锌、钙。
(1) 文中的“铁”“锌”“钙”指______
(2) 合理食用秋葵有助于缓解______
a. 贫血症
b. 佝偻病
c. 侏儒症
(3) 维生素A、胡萝卜素、纤维素都含有的元素是______
(1) 文中的“铁”“锌”“钙”指______
元素
(选填“分子”“原子”或“元素”)。(2) 合理食用秋葵有助于缓解______
abc
(填字母)。a. 贫血症
b. 佝偻病
c. 侏儒症
(3) 维生素A、胡萝卜素、纤维素都含有的元素是______
C、H(或碳、氢)
;维生素A中碳元素与氢元素的质量比为______8:1
。答案:【解析】
(1) 本题考查物质的组成描述。在描述物质的成分时,通常用“元素”来表示,因为物质是由元素组成的,而不是由分子或原子直接组成的(除非是单质)。文中的“铁”“锌”“钙”都是指秋葵中含有的元素,而不是具体的分子或原子。
【答案】元素
(2) 本题考查元素与人体健康的关系。铁是血红蛋白的组成部分,缺铁会导致贫血症;锌对儿童发育有重要影响,缺锌可能导致发育不良,但与侏儒症无直接关系;钙是骨骼的主要成分,缺钙会导致佝偻病。秋葵中含有丰富的铁、锌、钙,因此合理食用秋葵有助于缓解这些由元素缺乏引起的疾病。
【答案】a, b, c(或填“abc”)
(3) 本题考查化学式的意义及元素质量比的计算。观察维生素A($C_{20}H_{30}O$)、胡萝卜素($C_{40}H_{56}$)、纤维素$[(C_6H_{10}O_5)_n]$的化学式,可以看出它们都含有的元素是碳(C)和氢(H)。维生素A中碳元素与氢元素的质量比可以通过它们的相对原子质量乘以原子个数来计算,即$(12 × 20) : (1 × 30) = 240 : 30 = 8 : 1$。
【答案】C、H(或碳、氢);$8 : 1$
(1) 本题考查物质的组成描述。在描述物质的成分时,通常用“元素”来表示,因为物质是由元素组成的,而不是由分子或原子直接组成的(除非是单质)。文中的“铁”“锌”“钙”都是指秋葵中含有的元素,而不是具体的分子或原子。
【答案】元素
(2) 本题考查元素与人体健康的关系。铁是血红蛋白的组成部分,缺铁会导致贫血症;锌对儿童发育有重要影响,缺锌可能导致发育不良,但与侏儒症无直接关系;钙是骨骼的主要成分,缺钙会导致佝偻病。秋葵中含有丰富的铁、锌、钙,因此合理食用秋葵有助于缓解这些由元素缺乏引起的疾病。
【答案】a, b, c(或填“abc”)
(3) 本题考查化学式的意义及元素质量比的计算。观察维生素A($C_{20}H_{30}O$)、胡萝卜素($C_{40}H_{56}$)、纤维素$[(C_6H_{10}O_5)_n]$的化学式,可以看出它们都含有的元素是碳(C)和氢(H)。维生素A中碳元素与氢元素的质量比可以通过它们的相对原子质量乘以原子个数来计算,即$(12 × 20) : (1 × 30) = 240 : 30 = 8 : 1$。
【答案】C、H(或碳、氢);$8 : 1$
17. 大量实验证明,化学反应符合质量守恒定律。
(1) 右图是铁钉与硫酸铜溶液反应的实验。

① 反应一段时间,观察到的现象是
② 该反应的化学方程式是
③ 溶液中减少的铜元素质量等于反应生成的
(2) 取足量的铁、锌,各加入相同质量、相同溶质质量分数的稀盐酸,完全反应后,铁、锌均有剩余,下列说法正确的是
(3) 经计算,3 g镁和100 g质量分数为7.3%的盐酸充分反应可生成氢气0.2 g,但经实验测定,生成氢气的质量大于0.2 g。可能的原因是过量的镁与
(1) 右图是铁钉与硫酸铜溶液反应的实验。

① 反应一段时间,观察到的现象是
铁钉表面出现红色的物质,溶液由蓝色逐渐变为浅绿色
;② 该反应的化学方程式是
$Fe + CuSO_{4}=FeSO_{4}+Cu$
;③ 溶液中减少的铜元素质量等于反应生成的
铜(或$Cu$)
的质量。(2) 取足量的铁、锌,各加入相同质量、相同溶质质量分数的稀盐酸,完全反应后,铁、锌均有剩余,下列说法正确的是
AD
(填字母)。(3) 经计算,3 g镁和100 g质量分数为7.3%的盐酸充分反应可生成氢气0.2 g,但经实验测定,生成氢气的质量大于0.2 g。可能的原因是过量的镁与
水(或$H_{2}O$)
发生反应。答案:【解析】:
(1)①铁钉与硫酸铜溶液反应,生成硫酸亚铁和铜,硫酸亚铁溶液呈浅绿色,所以可观察到的现象是铁钉表面出现红色的物质,溶液由蓝色逐渐变为浅绿色;
②该反应的化学方程式为$Fe + CuSO_{4}=FeSO_{4}+Cu$;
③根据质量守恒定律,化学反应前后元素的种类和质量不变,溶液中减少的铜元素质量等于反应生成的铜的质量。
(2)取足量的铁、锌,各加入相同质量、相同溶质质量分数的稀盐酸,完全反应后,铁、锌均有剩余,说明稀盐酸完全反应。
A选项:因为稀盐酸完全反应,根据氢元素守恒,生成氢气的质量取决于稀盐酸中氢元素的质量,所以生成氢气的质量相等,A正确;
B选项:由于铁、锌质量未知且剩余,生成的氯化亚铁和氯化锌的质量不一定相等,B错误;
C选项:铁、锌均有剩余,参加反应的铁和锌的质量取决于稀盐酸中氯化氢的质量,由于氯化氢质量相同,但铁、锌相对原子质量不同,所以参加反应的铁和锌的质量不相等,C错误;
D选项:因为稀盐酸完全反应,所以参加反应的稀盐酸中$HCl$的质量相等,D正确。
(3)镁不仅能与盐酸反应生成氢气,还能与水在加热条件下反应生成氢气,所以生成氢气的质量大于与盐酸反应生成氢气的质量,可能是过量的镁与水发生反应。
【答案】:
(1)①铁钉表面出现红色的物质,溶液由蓝色逐渐变为浅绿色;②$Fe + CuSO_{4}=FeSO_{4}+Cu$;③铜(或$Cu$);
(2)AD;
(3)水(或$H_{2}O$)
(1)①铁钉与硫酸铜溶液反应,生成硫酸亚铁和铜,硫酸亚铁溶液呈浅绿色,所以可观察到的现象是铁钉表面出现红色的物质,溶液由蓝色逐渐变为浅绿色;
②该反应的化学方程式为$Fe + CuSO_{4}=FeSO_{4}+Cu$;
③根据质量守恒定律,化学反应前后元素的种类和质量不变,溶液中减少的铜元素质量等于反应生成的铜的质量。
(2)取足量的铁、锌,各加入相同质量、相同溶质质量分数的稀盐酸,完全反应后,铁、锌均有剩余,说明稀盐酸完全反应。
A选项:因为稀盐酸完全反应,根据氢元素守恒,生成氢气的质量取决于稀盐酸中氢元素的质量,所以生成氢气的质量相等,A正确;
B选项:由于铁、锌质量未知且剩余,生成的氯化亚铁和氯化锌的质量不一定相等,B错误;
C选项:铁、锌均有剩余,参加反应的铁和锌的质量取决于稀盐酸中氯化氢的质量,由于氯化氢质量相同,但铁、锌相对原子质量不同,所以参加反应的铁和锌的质量不相等,C错误;
D选项:因为稀盐酸完全反应,所以参加反应的稀盐酸中$HCl$的质量相等,D正确。
(3)镁不仅能与盐酸反应生成氢气,还能与水在加热条件下反应生成氢气,所以生成氢气的质量大于与盐酸反应生成氢气的质量,可能是过量的镁与水发生反应。
【答案】:
(1)①铁钉表面出现红色的物质,溶液由蓝色逐渐变为浅绿色;②$Fe + CuSO_{4}=FeSO_{4}+Cu$;③铜(或$Cu$);
(2)AD;
(3)水(或$H_{2}O$)