21. 兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行了相关探究。
[提出问题]它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
[实验探究1]向等体积、等浓度的碳酸氢钠、碳酸钠和氢氧化钠溶液中分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:

查阅资料:

[得出结论1]三种溶液的碱性由强到弱的顺序为
[实验探究2]甲同学在烧杯中加入约5 mL稀氢氧化钠溶液,再滴入几滴酚酞溶液,此时溶液由
[得出结论2]从微观角度分析,该反应的实质是
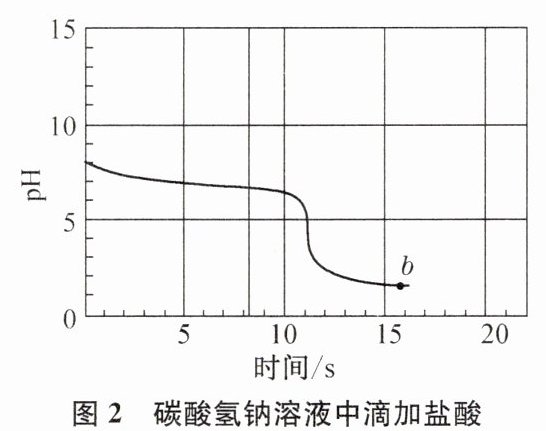
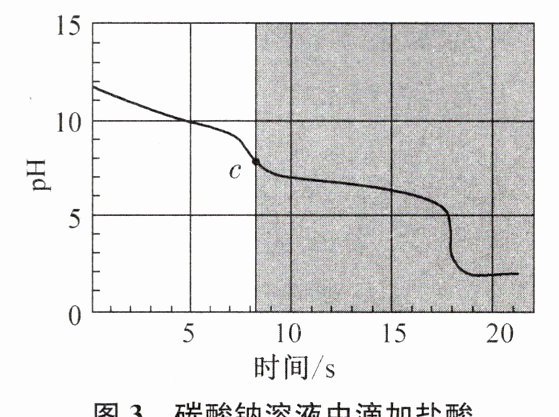
[实验探究3]向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。
[交流与反思]b点的溶质为
[得出结论3]通过上述分析,碳酸钠与盐酸反应的过程可用以下两个化学方程式表示:
[结论与反思]探究溶液的酸碱性及反应中pH的变化,可以认识反应的原理及进行的过程。
[提出问题]它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
[实验探究1]向等体积、等浓度的碳酸氢钠、碳酸钠和氢氧化钠溶液中分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:

查阅资料:

[得出结论1]三种溶液的碱性由强到弱的顺序为
氢氧化钠溶液>碳酸钠溶液>碳酸氢钠溶液
。[实验探究2]甲同学在烧杯中加入约5 mL稀氢氧化钠溶液,再滴入几滴酚酞溶液,此时溶液由
无
色变为色。向其中加入稀盐酸,该反应的化学方程式为$\mathrm{NaOH+HCl=NaCl+H_2O}$
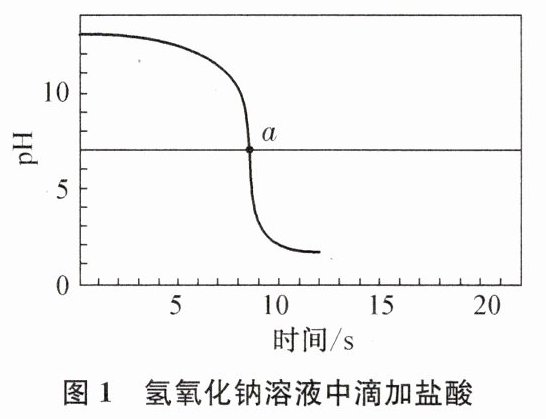
。乙同学向一定体积、一定浓度的氢氧化钠溶液中逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示。a点表示的含义是pH=7,恰好完全反应
。
[得出结论2]从微观角度分析,该反应的实质是
氢离子和氢氧根离子结合生成水分子
。[实验探究3]向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。


[交流与反思]b点的溶质为
NaCl、HCl
(填化学式)。将图2与图3中阴影部分进行叠加,发现两者基本重合,c点的溶质为NaCl、$\mathrm{NaHCO_3}$
(填化学式)。[得出结论3]通过上述分析,碳酸钠与盐酸反应的过程可用以下两个化学方程式表示:
$\mathrm{Na_2CO_3+HCl=NaHCO_3+NaCl}$
、$\mathrm{NaHCO_3+HCl=NaCl+H_2O+CO_2\uparrow}$
。[结论与反思]探究溶液的酸碱性及反应中pH的变化,可以认识反应的原理及进行的过程。
答案:21.[得出结论1]氢氧化钠溶液>碳酸钠溶液>碳酸氢钠溶液 [实验探究2]无 $\mathrm{NaOH+HCl=NaCl+H_2O}$ pH=7,恰好完全反应 [得出结论2]氢离子和氢氧根离子结合生成水分子 [交流与反思] NaCl、HCl NaCl、$\mathrm{NaHCO_3}$ [得出结论3] $\mathrm{Na_2CO_3+HCl=NaHCO_3+NaCl}$ $\mathrm{NaHCO_3+HCl=NaCl+H_2O+CO_2\uparrow}$
解析:
无 红 $\mathrm{NaOH+HCl=NaCl+H_2O}$ pH=7,恰好完全反应