9. 有 $\mathrm{a} 、 \mathrm{~b} 、 \mathrm{c}$ 三种金属, $\mathrm{a}$ 能从 $\mathrm{b}$ 的硝酸盐溶液中置换出 $\mathrm{b}$, 但 $\mathrm{a}$ 不能与稀盐酸反应;
$\mathrm{c}$ 能与稀盐酸反应产生 $\mathrm{H}_2$ 。 $\mathrm{a} 、 \mathrm{~b} 、 \mathrm{c}$ 的金属活动性由强到弱的顺序为
A.$\mathrm{a} 、 \mathrm{~b} 、 \mathrm{c}$
B.$\mathrm{a} 、 \mathrm{c} 、 \mathrm{~b}$
C.$\mathrm{c} 、 \mathrm{a} 、 \mathrm{~b}$
D.$\mathrm{c} 、 \mathrm{~b} 、 \mathrm{a}$
$\mathrm{c}$ 能与稀盐酸反应产生 $\mathrm{H}_2$ 。 $\mathrm{a} 、 \mathrm{~b} 、 \mathrm{c}$ 的金属活动性由强到弱的顺序为
A.$\mathrm{a} 、 \mathrm{~b} 、 \mathrm{c}$
B.$\mathrm{a} 、 \mathrm{c} 、 \mathrm{~b}$
C.$\mathrm{c} 、 \mathrm{a} 、 \mathrm{~b}$
D.$\mathrm{c} 、 \mathrm{~b} 、 \mathrm{a}$
答案:C
解析:
a能从b的硝酸盐溶液中置换出b,说明金属活动性a > b;a不能与稀盐酸反应,说明a的金属活动性排在H后;c能与稀盐酸反应产生H₂,说明c的金属活动性排在H前。综上,金属活动性由强到弱的顺序为c > a > b。
C
C
10. 逻辑推理是一种重要的化学思维方法。下列推理合理的是
A.因为碱溶液呈碱性,所以显碱性的溶液一定都是碱的溶液
B.因为 $\mathrm{H}_2 \mathrm{O}$ 和 $\mathrm{H}_2 \mathrm{O}_2$ 的组成元素相同,所以它们的化学性质相同
C.置换反应中一定有单质生成,则有单质生成的化学反应一定是置换反应
D.单质中只含有一种元素,但是只含有一种元素的物质不一定是单质
A.因为碱溶液呈碱性,所以显碱性的溶液一定都是碱的溶液
B.因为 $\mathrm{H}_2 \mathrm{O}$ 和 $\mathrm{H}_2 \mathrm{O}_2$ 的组成元素相同,所以它们的化学性质相同
C.置换反应中一定有单质生成,则有单质生成的化学反应一定是置换反应
D.单质中只含有一种元素,但是只含有一种元素的物质不一定是单质
答案:D
11. 欲在实验室配置 $100 \mathrm{~g} 16 \%$ 的氯化钠溶液进行选种,下列做法正确的是
A.计算:需要 $16 \mathrm{~g}$ 氯化钠, $100 \mathrm{~g}$ 水
B.称量:用托盘天平称量所需的氯化钠
C.量取:用 $50 \mathrm{~mL}$ 量筒量取所需的水
D.溶解:将称得的氯化钠倒入量筒溶解
A.计算:需要 $16 \mathrm{~g}$ 氯化钠, $100 \mathrm{~g}$ 水
B.称量:用托盘天平称量所需的氯化钠
C.量取:用 $50 \mathrm{~mL}$ 量筒量取所需的水
D.溶解:将称得的氯化钠倒入量筒溶解
答案:B
解析:
A. 计算:需要氯化钠的质量为$100\mathrm{g} × 16\% = 16\mathrm{g}$,需要水的质量为$100\mathrm{g}-16\mathrm{g}=84\mathrm{g}$,水的体积为$84\mathrm{mL}$,A错误;
B. 称量:用托盘天平称量所需的氯化钠,B正确;
C. 量取:应选用$100\mathrm{mL}$量筒量取$84\mathrm{mL}$水,C错误;
D. 溶解:应在烧杯中溶解氯化钠,不能在量筒中溶解,D错误。
结论:B
B. 称量:用托盘天平称量所需的氯化钠,B正确;
C. 量取:应选用$100\mathrm{mL}$量筒量取$84\mathrm{mL}$水,C错误;
D. 溶解:应在烧杯中溶解氯化钠,不能在量筒中溶解,D错误。
结论:B
12. 荷叶作为我国传统中药材之一,具有降脂、止血、清热解毒的功效,其中含有荷叶
碱 $\left(\mathrm{C}_{19} \mathrm{H}_{21} \mathrm{NO}_2\right)$ 。下列说法正确的是
A.荷叶碱中含有氧分子
B.一个荷叶碱分子含有 43 个原子
C.荷叶碱由五种元素组成
D.荷叶碱中碳、氢元素质量比为 $19: 21$
碱 $\left(\mathrm{C}_{19} \mathrm{H}_{21} \mathrm{NO}_2\right)$ 。下列说法正确的是
A.荷叶碱中含有氧分子
B.一个荷叶碱分子含有 43 个原子
C.荷叶碱由五种元素组成
D.荷叶碱中碳、氢元素质量比为 $19: 21$
答案:B
解析:
A. 荷叶碱由荷叶碱分子构成,不含氧分子。
B. 一个荷叶碱分子含有的原子数:$19 + 21 + 1 + 2 = 43$。
C. 荷叶碱由碳、氢、氮、氧四种元素组成。
D. 荷叶碱中碳、氢元素质量比为$(12×19):(1×21) = 228:21 = 76:7$。
结论:B
B. 一个荷叶碱分子含有的原子数:$19 + 21 + 1 + 2 = 43$。
C. 荷叶碱由碳、氢、氮、氧四种元素组成。
D. 荷叶碱中碳、氢元素质量比为$(12×19):(1×21) = 228:21 = 76:7$。
结论:B
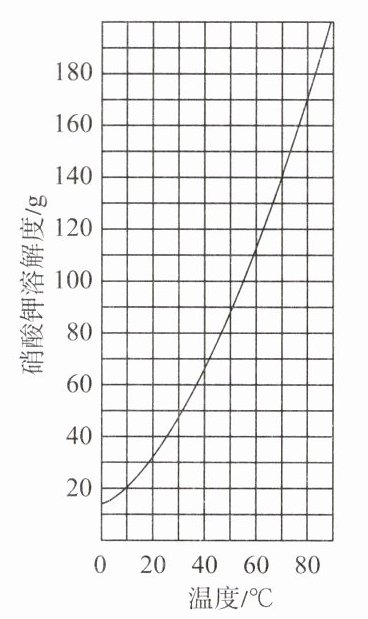
13. 硝酸钾的溶解度曲线如图所示, 将 $100 \mathrm{~g} 60^{\circ} \mathrm{C}$ 的硝酸钾饱和溶液分别进行如下
操作后,所得溶液与原溶液相比,变化结果完全正确的是
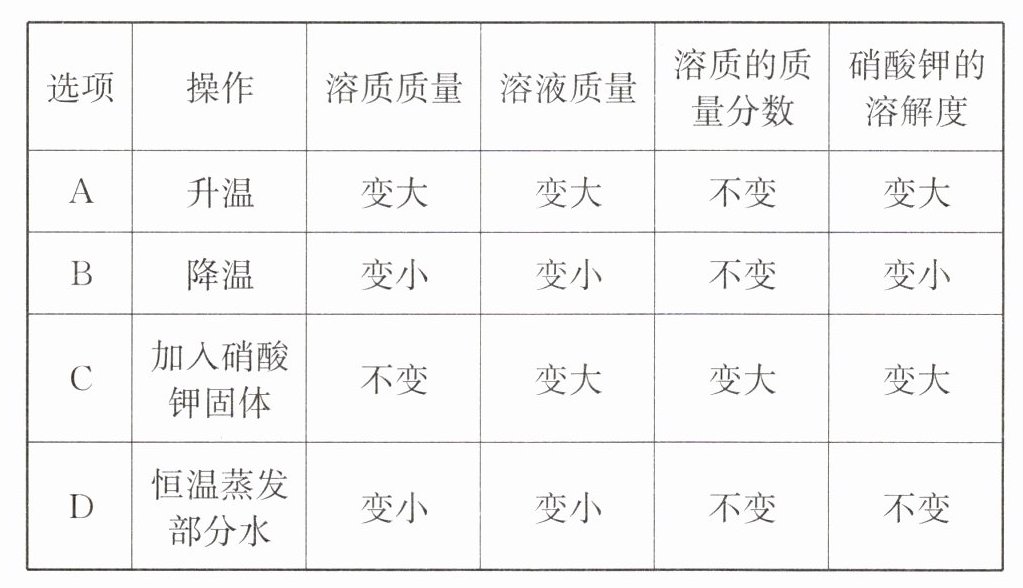
操作后,所得溶液与原溶液相比,变化结果完全正确的是


答案:D
解析:
解:
选项A:升温后,硝酸钾溶解度变大,原饱和溶液变为不饱和溶液,溶质质量、溶液质量、溶质质量分数均不变,A错误。
选项B:降温后,溶解度变小,溶质析出,溶质质量、溶液质量变小,溶质质量分数变小,B错误。
选项C:加入硝酸钾固体,原溶液已饱和,不能继续溶解,溶质质量、溶液质量、溶质质量分数均不变,溶解度不变,C错误。
选项D:恒温蒸发部分水,溶解度不变,溶剂减少,溶质析出,溶质质量、溶液质量变小,溶质质量分数不变,D正确。
结论:D
选项A:升温后,硝酸钾溶解度变大,原饱和溶液变为不饱和溶液,溶质质量、溶液质量、溶质质量分数均不变,A错误。
选项B:降温后,溶解度变小,溶质析出,溶质质量、溶液质量变小,溶质质量分数变小,B错误。
选项C:加入硝酸钾固体,原溶液已饱和,不能继续溶解,溶质质量、溶液质量、溶质质量分数均不变,溶解度不变,C错误。
选项D:恒温蒸发部分水,溶解度不变,溶剂减少,溶质析出,溶质质量、溶液质量变小,溶质质量分数不变,D正确。
结论:D
14. 根据下列实验事实得出的结论不正确的是


答案:A