9. 下列叙述错误的是(
A.推广使用"国四"汽油能减少有害气体的排放
B.扑灭图书档案火灾最适宜用液态二氧化碳灭火器
C.常用钢丝球擦洗铝壶可以使其光亮洁净和更耐用
D.波尔多液不可以盛装在铁制容器内
C
)A.推广使用"国四"汽油能减少有害气体的排放
B.扑灭图书档案火灾最适宜用液态二氧化碳灭火器
C.常用钢丝球擦洗铝壶可以使其光亮洁净和更耐用
D.波尔多液不可以盛装在铁制容器内
答案:9.C
10. 下列粒子结构示意图中,表示原子的是(
A.
B.
C.
D.
B
)
A.
B.
C.
D.
答案:10.B
解析:
解:在粒子结构示意图中,原子的核内质子数等于核外电子数。
A. 质子数=9,核外电子数=2+8=10,9≠10,不是原子。
B. 质子数=10,核外电子数=2+8=10,10=10,是原子。
C. 质子数=11,核外电子数=2+8=10,11≠10,不是原子。
D. 质子数=12,核外电子数=2+8=10,12≠10,不是原子。
答案:B
A. 质子数=9,核外电子数=2+8=10,9≠10,不是原子。
B. 质子数=10,核外电子数=2+8=10,10=10,是原子。
C. 质子数=11,核外电子数=2+8=10,11≠10,不是原子。
D. 质子数=12,核外电子数=2+8=10,12≠10,不是原子。
答案:B
11. 某同学总结了食盐、纯碱、小苏打和碳酸钙的用途,其中错误的一项是(
A.食盐可用作调味品
B.纯碱可治理盐碱地
C.碳酸钙可作补钙剂
D.小苏打可治疗胃酸过多
B
)A.食盐可用作调味品
B.纯碱可治理盐碱地
C.碳酸钙可作补钙剂
D.小苏打可治疗胃酸过多
答案:11.B
12. 把下列各组物质加人足量的水中,搅拌后只得到无色、澄清溶液的一组是(
A.$NaCl$、$CuSO_4$、$KOH$
B.$KNO_3$、$BaCl_2$、$NaOH$
C.$K_2CO_3$、$Na_2SO_4$、$CaCl_2$
D.$MgCl_2$、$KNO_3$、$BaCO_3$
B
)A.$NaCl$、$CuSO_4$、$KOH$
B.$KNO_3$、$BaCl_2$、$NaOH$
C.$K_2CO_3$、$Na_2SO_4$、$CaCl_2$
D.$MgCl_2$、$KNO_3$、$BaCO_3$
答案:12.B
13. 化学中有多种“守恒”。下列描述中对各种“守恒”的解释错误的是(
A.质量守恒——参加反应的各物质的质量总和等于生成的各物质的质量总和
B.溶质守恒——溶液在稀释前后溶质的体积不变
C.元素守恒——化学反应前后元素的种类和质量不变
D.原子守恒——化学反应前后原子的种类及数目不变
B
)A.质量守恒——参加反应的各物质的质量总和等于生成的各物质的质量总和
B.溶质守恒——溶液在稀释前后溶质的体积不变
C.元素守恒——化学反应前后元素的种类和质量不变
D.原子守恒——化学反应前后原子的种类及数目不变
答案:13.B
14. 甲、乙两种固体物质的溶解度曲线如图所示。下列有关叙述错误的是(
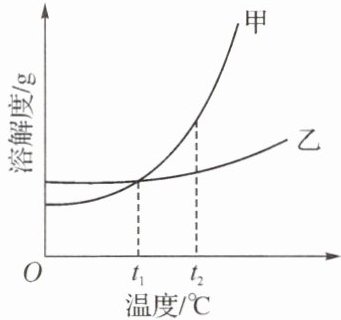
A.$t_2^{\circ}C$时甲的溶解度比乙的大
B.将甲、乙的饱和溶液从 $t_2^{\circ}C$ 降到 $t_1^{\circ}C$, 析出甲的质量大
C.升高温度可将甲的饱和溶液变成不饱和溶液
D.$t_1^{\circ}C$ 时, 甲和乙的饱和溶液各 $100g$, 其溶质的质量一定相等
B
)
A.$t_2^{\circ}C$时甲的溶解度比乙的大
B.将甲、乙的饱和溶液从 $t_2^{\circ}C$ 降到 $t_1^{\circ}C$, 析出甲的质量大
C.升高温度可将甲的饱和溶液变成不饱和溶液
D.$t_1^{\circ}C$ 时, 甲和乙的饱和溶液各 $100g$, 其溶质的质量一定相等
答案:14.B
15. 捕集 $CO_2$ 合成尿素 $[CO(NH_2)_2]$, 可实现 $CO_2$ 资源化利用, 转化流程如图所示。下列说法不正确的是(
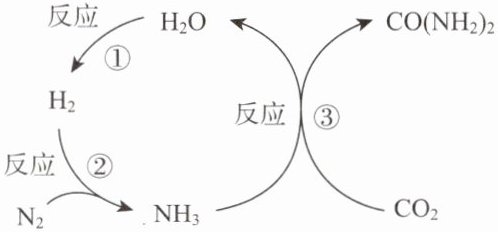
A.理论上,反应②中合成 $3.4tNH_3$ 需要 $0.6tH_2$
B.理论上,反应③中参加反应的 $NH_3$ 和 $CO_2$ 的质量之比为 $17:22$
C.该转化流程中,$H_2O$ 可循环利用,无需额外补充
D.该转化流程中,分子总数减少
C
)
A.理论上,反应②中合成 $3.4tNH_3$ 需要 $0.6tH_2$
B.理论上,反应③中参加反应的 $NH_3$ 和 $CO_2$ 的质量之比为 $17:22$
C.该转化流程中,$H_2O$ 可循环利用,无需额外补充
D.该转化流程中,分子总数减少
答案:15.C
解析:
A. 反应②为${N2 + 3H2\xlongequal{一定条件}2NH3}$,设需要${H2}$质量为$x$,$\frac{6}{34}=\frac{x}{3.4\ \mathrm{t}}$,解得$x = 0.6\ \mathrm{t}$,正确。
B. 反应③为${2NH3 + CO2\xlongequal{一定条件}CO(NH2)2 + H2O}$,${NH3}$与${CO2}$质量比为$(2×17):44 = 17:22$,正确。
C. 反应①生成${H2O}$,反应③消耗${H2O}$,无法判断是否需额外补充,错误。
D. 总反应为${CO2 + N2 + 3H2\xlongequal{一定条件}CO(NH2)2 + H2O}$,反应前分子总数$5$,反应后$2$,分子总数减少,正确。
C
B. 反应③为${2NH3 + CO2\xlongequal{一定条件}CO(NH2)2 + H2O}$,${NH3}$与${CO2}$质量比为$(2×17):44 = 17:22$,正确。
C. 反应①生成${H2O}$,反应③消耗${H2O}$,无法判断是否需额外补充,错误。
D. 总反应为${CO2 + N2 + 3H2\xlongequal{一定条件}CO(NH2)2 + H2O}$,反应前分子总数$5$,反应后$2$,分子总数减少,正确。
C
16. $20^{\circ}C$ 时, 将 $30g$ 固体 (含有氯化钾及不溶于水的杂质) 置于烧杯内, 进行如图所示的实验, 实验过程中溶液温度没有明显变化。

(1) 溶液①~③中,溶液
(2) $x$ 的数值是
(3) $20^{\circ}C$ 时, 氯化钾的溶解度为
(4) 溶液②与溶液③的溶质质量分数

(1) 溶液①~③中,溶液
①
是饱和溶液。(2) $x$ 的数值是
5
。(3) $20^{\circ}C$ 时, 氯化钾的溶解度为
34
$g$。(4) 溶液②与溶液③的溶质质量分数
不相等
(填“相等”或“不相等”)。答案:16.(1)① (2)5 (3)34 (4)不相等