22. 以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”, 它是目前化学工业的重要支柱之一。
(1) 由于粗盐中含有少量 $MgCl_2$、$CaCl_2$、$Na_2SO_4$ 等杂质, 不符合电解要求, 因此必须经过精制。下图是粗盐精制的流程:
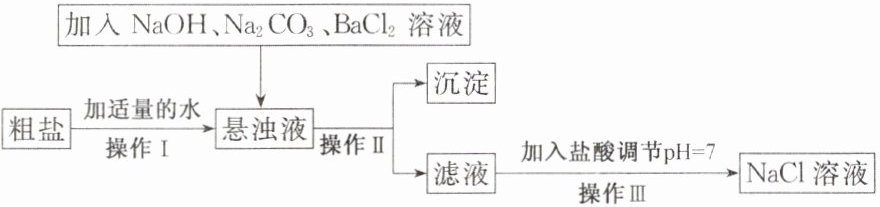
回答下列问题:
① 操作Ⅱ的名称是
② 在悬浊液中加 $NaOH$ 溶液、$Na_2CO_3$ 溶液、$BaCl_2$ 溶液三种试剂的顺序合理的为
A. 先加人 $NaOH$ 溶液, 后加人 $Na_2CO_3$ 溶液, 再加人 $BaCl_2$ 溶液
B. 先加人 $NaOH$ 溶液, 后加人 $BaCl_2$ 溶液, 再加人 $Na_2CO_3$ 溶液
C. 先加人 $BaCl_2$ 溶液, 后加人 $NaOH$ 溶液, 再加人 $Na_2CO_3$ 溶液
D. 先加人 $BaCl_2$ 溶液, 后加人 $Na_2CO_3$ 溶液, 再加人 $NaOH$ 溶液
有同学提出用
(2) 下图是电解食盐水制取氯气、氢氧化钠等产品的流程:
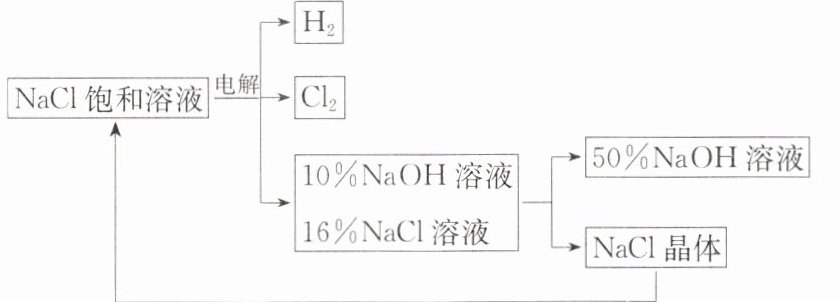
① 在电解过程中, 发生的反应为 $2NaCl + 2H_2O \xlongequal{通电} Cl_2 \uparrow + H_2 \uparrow + 2NaOH$, 电解后溶液的 $pH$
② 电解食盐水时, 需防止 $Cl_2$ 和 $NaOH$ 反应, 因 $Cl_2$ 和 $NaOH$ 溶液充分接触会生成 $NaClO$、氯化钠、水, 请写出 $Cl_2$ 和 $NaOH$ 溶液反应的化学方程式:
③ 该流程中可以循环利用的物质是
④ 若取 $100g$ 的溶质质量分数为 $25\%$ 的氯化钠溶液进行电解, 一段时间后停止通电, 生成氯气的质量为 $7.1g$。请计算: 生成氢气的质量为多少克? 反应后溶液中 $NaOH$ 的质量分数是多少? (写出计算过程, 计算结果精确到 $0.1\%$)
⑤ 若要使 (2) 中电解后的溶液恢复到原来状态, 则需向溶液中加人适量的
(1) 由于粗盐中含有少量 $MgCl_2$、$CaCl_2$、$Na_2SO_4$ 等杂质, 不符合电解要求, 因此必须经过精制。下图是粗盐精制的流程:

回答下列问题:
① 操作Ⅱ的名称是
过滤
。② 在悬浊液中加 $NaOH$ 溶液、$Na_2CO_3$ 溶液、$BaCl_2$ 溶液三种试剂的顺序合理的为
BCD
(填序号)。A. 先加人 $NaOH$ 溶液, 后加人 $Na_2CO_3$ 溶液, 再加人 $BaCl_2$ 溶液
B. 先加人 $NaOH$ 溶液, 后加人 $BaCl_2$ 溶液, 再加人 $Na_2CO_3$ 溶液
C. 先加人 $BaCl_2$ 溶液, 后加人 $NaOH$ 溶液, 再加人 $Na_2CO_3$ 溶液
D. 先加人 $BaCl_2$ 溶液, 后加人 $Na_2CO_3$ 溶液, 再加人 $NaOH$ 溶液
有同学提出用
$Ba(OH)_{2}$
溶液代替 $BaCl_2$ 溶液可达到同样的目的。(2) 下图是电解食盐水制取氯气、氢氧化钠等产品的流程:

① 在电解过程中, 发生的反应为 $2NaCl + 2H_2O \xlongequal{通电} Cl_2 \uparrow + H_2 \uparrow + 2NaOH$, 电解后溶液的 $pH$
升高
(填“升高”“不变”或“降低”)。② 电解食盐水时, 需防止 $Cl_2$ 和 $NaOH$ 反应, 因 $Cl_2$ 和 $NaOH$ 溶液充分接触会生成 $NaClO$、氯化钠、水, 请写出 $Cl_2$ 和 $NaOH$ 溶液反应的化学方程式:
$2NaOH+Cl_{2}=NaClO+NaCl+H_{2}O$
。③ 该流程中可以循环利用的物质是
$NaCl$
。④ 若取 $100g$ 的溶质质量分数为 $25\%$ 的氯化钠溶液进行电解, 一段时间后停止通电, 生成氯气的质量为 $7.1g$。请计算: 生成氢气的质量为多少克? 反应后溶液中 $NaOH$ 的质量分数是多少? (写出计算过程, 计算结果精确到 $0.1\%$)
⑤ 若要使 (2) 中电解后的溶液恢复到原来状态, 则需向溶液中加人适量的
$HCl$(或氯化氢)
。答案:22.(1)①过滤 ②BCD $Ba(OH)_{2}$
(2)①升高
②$2NaOH+Cl_{2}=NaClO+NaCl+H_{2}O$
③$NaCl$
④解:设生成氢气的质量为x,氢氧化钠的质量为y。
$2NaCl + 2H_{2}O\stackrel{通电}{=}Cl_{2}\uparrow + H_{2}\uparrow + 2NaOH$
$71$ $2$ $80$
$7.1g$ $x$ $y$
$\frac{71}{2}=\frac{7.1g}{x}$,解得$x = 0.2g$。
$\frac{71}{80}=\frac{7.1g}{y}$,解得$y = 8g$。
反应后所得溶液中溶质质量分数:
$\frac{8g}{100g - 7.1g - 0.2g}×100\%\approx8.6\%$。
答:生成氢气的质量为$0.2g$,反应后溶液中$NaOH$的质量分数是$8.6\%$。
⑤$HCl$(或氯化氢)
(2)①升高
②$2NaOH+Cl_{2}=NaClO+NaCl+H_{2}O$
③$NaCl$
④解:设生成氢气的质量为x,氢氧化钠的质量为y。
$2NaCl + 2H_{2}O\stackrel{通电}{=}Cl_{2}\uparrow + H_{2}\uparrow + 2NaOH$
$71$ $2$ $80$
$7.1g$ $x$ $y$
$\frac{71}{2}=\frac{7.1g}{x}$,解得$x = 0.2g$。
$\frac{71}{80}=\frac{7.1g}{y}$,解得$y = 8g$。
反应后所得溶液中溶质质量分数:
$\frac{8g}{100g - 7.1g - 0.2g}×100\%\approx8.6\%$。
答:生成氢气的质量为$0.2g$,反应后溶液中$NaOH$的质量分数是$8.6\%$。
⑤$HCl$(或氯化氢)