20. (9 分)根据下列实验装置图,回答有关问题。
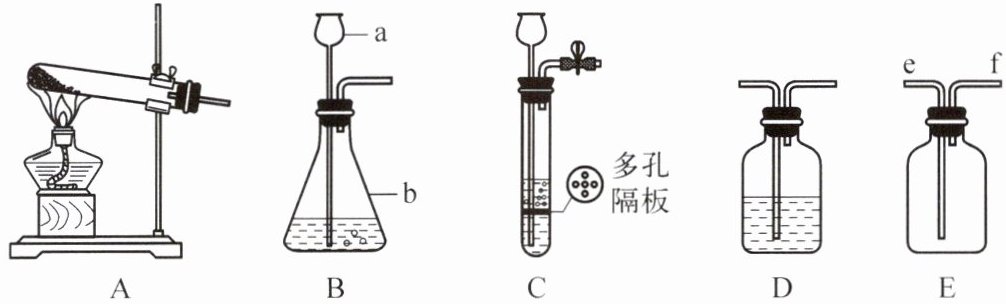
(1) 写出仪器 b 的名称
(2) 实验室若要制取干燥的二氧化碳,反应的化学方程式为
(3) 实验室若要制取氢气,可将 B 装置改进为 C 装置,其改进后的优点是
(4) 实验室须用高锰酸钾制取 1.6g 氧气,理论上至少需要多少克高锰酸钾?

(1) 写出仪器 b 的名称
锥形瓶
。(2) 实验室若要制取干燥的二氧化碳,反应的化学方程式为
$\mathrm{CaCO_3+2HCl=CaCl_2+H_2O+CO_2↑}$
,除发生装置外,还应选用 D 装置,并在该装置中盛放浓硫酸
(填试剂名称)。(3) 实验室若要制取氢气,可将 B 装置改进为 C 装置,其改进后的优点是
可以控制反应的发生与停止
,用 E 装置收集该气体,则气体从f
(填“e”或“f”)端进入。(4) 实验室须用高锰酸钾制取 1.6g 氧气,理论上至少需要多少克高锰酸钾?
答案:20.(1)锥形瓶 (2)$\mathrm{CaCO_3+2HCl=CaCl_2+H_2O+CO_2↑}$ 浓硫酸 (3)可以控制反应的发生与停止 f (4)解:设需要高锰酸钾的质量为$x$。
$\begin{array}{c}2\mathrm{KMnO_4}\stackrel{\triangle}{=}\mathrm{K_2MnO_4}+\mathrm{MnO_2}+\mathrm{O_2↑}\\316\qquad\qquad\qquad\qquad\qquad32\\x\qquad\qquad\qquad\qquad\qquad1.6g\end{array}$
$\frac{316}{32}=\frac{x}{1.6g}$
$x = 15.8g$
答:理论上至少需要高锰酸钾的质量为15.8g。
$\begin{array}{c}2\mathrm{KMnO_4}\stackrel{\triangle}{=}\mathrm{K_2MnO_4}+\mathrm{MnO_2}+\mathrm{O_2↑}\\316\qquad\qquad\qquad\qquad\qquad32\\x\qquad\qquad\qquad\qquad\qquad1.6g\end{array}$
$\frac{316}{32}=\frac{x}{1.6g}$
$x = 15.8g$
答:理论上至少需要高锰酸钾的质量为15.8g。
21. (7 分)硫酸锌可作为食品添加剂。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是 ZnCO₃,并含少量的 FeO、CuO。工艺流程如下图所示(假设每一步骤反应均完全):
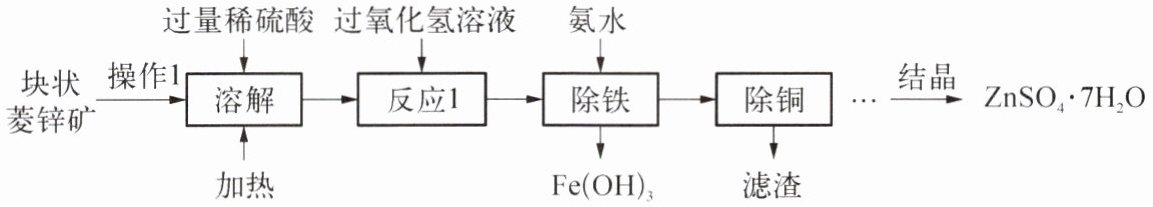
(1) 为提高矿石的溶解速度,操作 1 是
(2) 菱锌矿溶解后所得的溶液中阳离子有
(3) 反应 1 中 H₂O₂转化为 H₂O,同时有 Fe₂(SO₄)₃生成,写出反应 1 中生成 Fe₂(SO₄)₃的化学方程式:
(4) 结晶之前,溶液中除了硫酸锌,还一定存在的溶质是
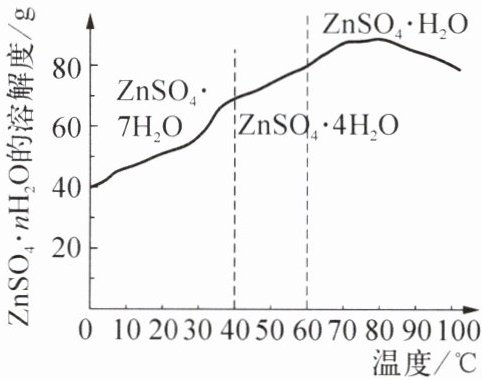
(5) 硫酸锌晶体的溶解度曲线如右图所示,若要获得 ZnSO₄·7H₂O 晶体,应控制结晶时的温度范围为
(6) 流程中还可能得到一种紫罗兰色的晶体(NH₄)ₓFeᵧ(SO₄)z·7H₂O。
已知该化合物中氮、铁元素的质量比为 1:4,则 x:y:z=

(1) 为提高矿石的溶解速度,操作 1 是
粉碎
。(2) 菱锌矿溶解后所得的溶液中阳离子有
4
种。(3) 反应 1 中 H₂O₂转化为 H₂O,同时有 Fe₂(SO₄)₃生成,写出反应 1 中生成 Fe₂(SO₄)₃的化学方程式:
$\mathrm{2FeSO_4+H_2O_2+H_2SO_4=Fe_2(SO_4)_3+2H_2O}$
。(4) 结晶之前,溶液中除了硫酸锌,还一定存在的溶质是
$\mathrm{(NH_4)_2SO_4}$
(填化学式)。(5) 硫酸锌晶体的溶解度曲线如右图所示,若要获得 ZnSO₄·7H₂O 晶体,应控制结晶时的温度范围为
$0\sim40^{\circ}C$
。
(6) 流程中还可能得到一种紫罗兰色的晶体(NH₄)ₓFeᵧ(SO₄)z·7H₂O。
已知该化合物中氮、铁元素的质量比为 1:4,则 x:y:z=
$1:1:2$
。答案:21.(1)粉碎 (2)4 (3)$\mathrm{2FeSO_4+H_2O_2+H_2SO_4=Fe_2(SO_4)_3+2H_2O}$ (4)$\mathrm{(NH_4)_2SO_4}$ (5)$0\sim40^{\circ}C$ (6)$1:1:2$