4. 下列实验设计能达到实验目的的是(
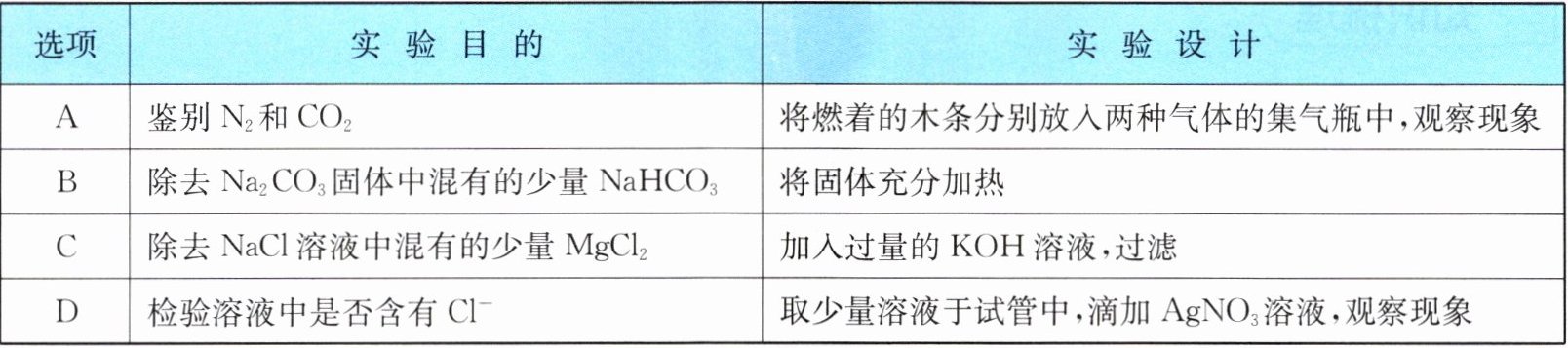
B
)
答案:4 B
5. 以典型物质为核心,进行问题的设置与整合是我们全面认识物质性质及应用的有效途径。小明同学在小组合作学习过程中,对氢氧化钠和碳酸钠的有关问题以结构图的形式进行了右下图梳理。联系实际,解决问题。
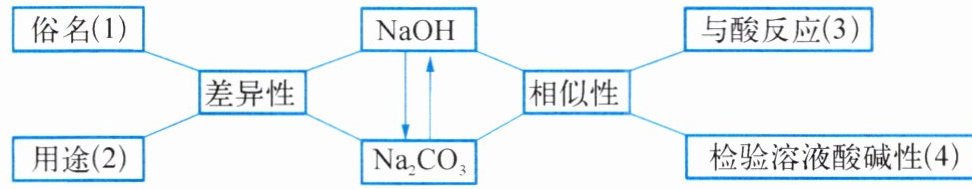
(1)氢氧化钠的俗名为
(2)在工业上,碳酸钠广泛用于造纸、纺织和
(3)碳酸钠溶液与稀硫酸反应的实验现象是
(4)实验室常用
(5)${Na_{2}CO_{3}}$转化为${NaOH}$的化学方程式为

(1)氢氧化钠的俗名为
火碱、烧碱、苛性钠
(写出两种)。(2)在工业上,碳酸钠广泛用于造纸、纺织和
玻璃(或日用化学工业)
等。(3)碳酸钠溶液与稀硫酸反应的实验现象是
产生大量气泡
,其反应的化学方程式为$\mathrm{Na}_2\mathrm{CO}_3 + \mathrm{H}_2\mathrm{SO}_4 \longrightarrow \mathrm{Na}_2\mathrm{SO}_4 + \mathrm{H}_2\mathrm{O} + \mathrm{CO}_2 \uparrow$
。(4)实验室常用
酚酞溶液(合理即可)
检验两种溶液的酸碱性。(5)${Na_{2}CO_{3}}$转化为${NaOH}$的化学方程式为
$\mathrm{Na}_2\mathrm{CO}_3 + \mathrm{Ca(OH)}_2 \longrightarrow \mathrm{CaCO}_3 \downarrow + 2\mathrm{NaOH}$
。答案:5 (1) 火碱、烧碱、苛性钠 (2) 玻璃(或日用化学工业) (3) 产生大量气泡 $\mathrm{Na}_2\mathrm{CO}_3 + \mathrm{H}_2\mathrm{SO}_4 \longrightarrow \mathrm{Na}_2\mathrm{SO}_4 + \mathrm{H}_2\mathrm{O} + \mathrm{CO}_2 \uparrow$ (4) 酚酞溶液(合理即可) (5) $\mathrm{Na}_2\mathrm{CO}_3 + \mathrm{Ca(OH)}_2 \longrightarrow \mathrm{CaCO}_3 \downarrow + 2\mathrm{NaOH}$
6. 高纯氧化钙是一种重要的化工原料。下图为小组同学以某工厂废渣(主要成分为${CaCO_{3}}$,含少量${Fe_{2}O_{3}}$和${MgCO_{3}}$)为原料,在实验室制备高纯氧化钙的实验方案。
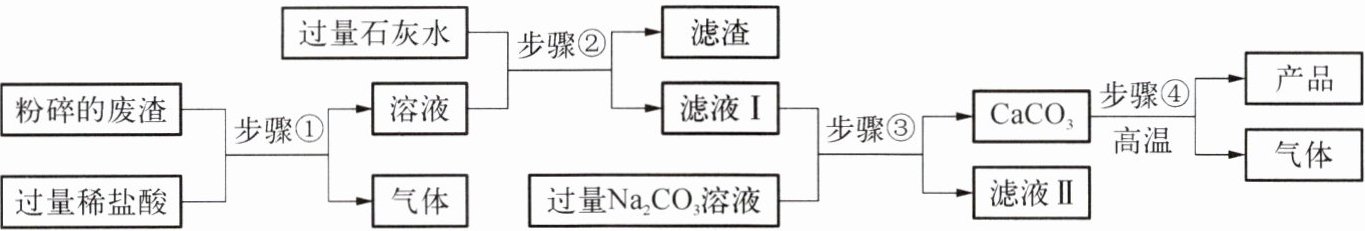
请回答下列问题:
(1)氧化钙的化学式为
(2)将废渣粉碎为细小颗粒的目的是
(3)步骤②中过滤时玻璃棒的作用是
(4)步骤③中反应的化学方程式为
(5)以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,会使产品的产量

请回答下列问题:
(1)氧化钙的化学式为
CaO
。(2)将废渣粉碎为细小颗粒的目的是
增大反应物之间的接触面积,使反应更充分
。(3)步骤②中过滤时玻璃棒的作用是
引流
。(4)步骤③中反应的化学方程式为
$\mathrm{Ca(OH)}_2 + \mathrm{Na}_2\mathrm{CO}_3 \longrightarrow \mathrm{CaCO}_3 \downarrow + 2\mathrm{NaOH}$(或 $\mathrm{CaCl}_2 + \mathrm{Na}_2\mathrm{CO}_3 \longrightarrow \mathrm{CaCO}_3 \downarrow +$
(写一个即可)。(5)以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,会使产品的产量
降低
(填“提高”“不变”或“降低”)。答案:6 (1) CaO (2) 增大反应物之间的接触面积,使反应更充分 (3) 引流 (4) $\mathrm{Ca(OH)}_2 + \mathrm{Na}_2\mathrm{CO}_3 \longrightarrow \mathrm{CaCO}_3 \downarrow + 2\mathrm{NaOH}$(或 $\mathrm{CaCl}_2 + \mathrm{Na}_2\mathrm{CO}_3 \longrightarrow \mathrm{CaCO}_3 \downarrow +$ (5) 降低
解析:
(1) $\mathrm{CaO}$
(2) 增大反应物之间的接触面积,使反应更充分
(3) 引流
(4) $\mathrm{Ca(OH)_2 + Na_2CO_3 = CaCO_3 \downarrow + 2NaOH}$(或 $\mathrm{CaCl_2 + Na_2CO_3 = CaCO_3 \downarrow + 2NaCl}$)
(5) 降低
(2) 增大反应物之间的接触面积,使反应更充分
(3) 引流
(4) $\mathrm{Ca(OH)_2 + Na_2CO_3 = CaCO_3 \downarrow + 2NaOH}$(或 $\mathrm{CaCl_2 + Na_2CO_3 = CaCO_3 \downarrow + 2NaCl}$)
(5) 降低