1. (2025·宿迁宿城段考)下列宿迁特色产业生产过程中主要涉及化学变化的是 (
A.采摘园用草莓榨汁
B.红薯晒成红薯干
C.洋河酒厂用粮食酿酒
D.木材制成桌椅
C
)A.采摘园用草莓榨汁
B.红薯晒成红薯干
C.洋河酒厂用粮食酿酒
D.木材制成桌椅
答案:C
2. 下列物质的性质与用途具有对应关系的是 (
A.活性炭有吸附性,可用于净水
B.石墨有导电性,可用于生产铅笔芯
C.金刚石璀璨夺目,可用于切割玻璃
D.氮气常温下无色、无味,用作食品的保护气
A
)A.活性炭有吸附性,可用于净水
B.石墨有导电性,可用于生产铅笔芯
C.金刚石璀璨夺目,可用于切割玻璃
D.氮气常温下无色、无味,用作食品的保护气
答案:A
3. 写出下列反应的化学方程式及(2)(3)的基本反应类型。
(1) 红磷在氧气中燃烧的反应:
(2) 最清洁的燃料的燃烧反应:
(3) 过氧化氢溶液和二氧化锰混合制氧气:
(4) 氢气在高温条件下与四氧化三铁反应生成铁和水:
(1) 红磷在氧气中燃烧的反应:
$ 4P + 5O_2 \xlongequal{点燃} 2P_2O_5 $
。(2) 最清洁的燃料的燃烧反应:
$ 2H_2 + O_2 \xlongequal{点燃} 2H_2O $
,基本反应类型:化合反应
。(3) 过氧化氢溶液和二氧化锰混合制氧气:
$ 2H_2O_2 \xlongequal{MnO_2} 2H_2O + O_2 \uparrow $
,基本反应类型:分解反应
。(4) 氢气在高温条件下与四氧化三铁反应生成铁和水:
$ 4H_2 + Fe_3O_4 \xlongequal{高温} 3Fe + 4H_2O $
。答案:(1) $ 4P + 5O_2 \xlongequal{点燃} 2P_2O_5 $
(2) $ 2H_2 + O_2 \xlongequal{点燃} 2H_2O $ 化合反应
(3) $ 2H_2O_2 \xlongequal{MnO_2} 2H_2O + O_2 \uparrow $ 分解反应
(4) $ 4H_2 + Fe_3O_4 \xlongequal{高温} 3Fe + 4H_2O $
(2) $ 2H_2 + O_2 \xlongequal{点燃} 2H_2O $ 化合反应
(3) $ 2H_2O_2 \xlongequal{MnO_2} 2H_2O + O_2 \uparrow $ 分解反应
(4) $ 4H_2 + Fe_3O_4 \xlongequal{高温} 3Fe + 4H_2O $
4. (传统文化)古有《齐民要术》记载“粟米曲作酢”,“酢”即醋酸;今有我国科研人员研究出制取醋酸($CH_{3}COOH$)的新方法。新方法的反应微观示意图如图所示。
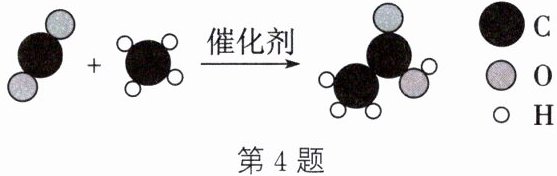
(1) 古法酿醋是用粮食经过发酵而成的,发酵属于
(2) 保持醋酸化学性质的最小微观粒子是
(3) 新方法的反应的化学方程式为
(4) 这一新方法的重要意义除了制取醋酸外,还有助于减缓

(1) 古法酿醋是用粮食经过发酵而成的,发酵属于
化学
变化。(2) 保持醋酸化学性质的最小微观粒子是
醋酸分子
。(3) 新方法的反应的化学方程式为
$ CO_2 + CH_4 \xlongequal{催化剂} CH_3COOH $
;两种反应物共含有18g碳元素,当反应物全部反应生成醋酸时,消耗$CO_{2}$的质量是33
g。(4) 这一新方法的重要意义除了制取醋酸外,还有助于减缓
温室
效应加剧。答案:(1) 化学
(2) 醋酸分子
(3) $ CO_2 + CH_4 \xlongequal{催化剂} CH_3COOH $ 33
(4) 温室
解析:(3) 由反应的微观示意图可知,二氧化碳和甲烷在催化剂作用下反应生成醋酸,反应的化学方程式为 $ CO_2 + CH_4 \xlongequal{催化剂} CH_3COOH $;由化学方程式可知,当反应物全部反应生成醋酸时,来自 $ CO_2 $ 和 $ CH_4 $ 的碳元素质量相等,所以消耗 $ CO_2 $ 的质量为 $ \frac{\frac{18g}{2}}{\frac{12}{44} × 100\%} = 33g $。
(2) 醋酸分子
(3) $ CO_2 + CH_4 \xlongequal{催化剂} CH_3COOH $ 33
(4) 温室
解析:(3) 由反应的微观示意图可知,二氧化碳和甲烷在催化剂作用下反应生成醋酸,反应的化学方程式为 $ CO_2 + CH_4 \xlongequal{催化剂} CH_3COOH $;由化学方程式可知,当反应物全部反应生成醋酸时,来自 $ CO_2 $ 和 $ CH_4 $ 的碳元素质量相等,所以消耗 $ CO_2 $ 的质量为 $ \frac{\frac{18g}{2}}{\frac{12}{44} × 100\%} = 33g $。
5. 下列应用守恒思想解决相关问题,推论正确的是 (
A.24g镁与32g氧气反应,根据质量守恒推出生成的氧化镁的质量为56g
B.聚乙烯完全燃烧生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧元素组成
C.5g酒精与5g水混合,根据质量守恒推出得到10g酒精溶液
D.1g硫与1g氧气反应,根据质量守恒推出生成的二氧化硫的质量为2g
D
)A.24g镁与32g氧气反应,根据质量守恒推出生成的氧化镁的质量为56g
B.聚乙烯完全燃烧生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧元素组成
C.5g酒精与5g水混合,根据质量守恒推出得到10g酒精溶液
D.1g硫与1g氧气反应,根据质量守恒推出生成的二氧化硫的质量为2g
答案:D
解析:
解:
A. 镁与氧气反应的化学方程式为 $2Mg + O_2 \stackrel{点燃}{=\!=\!=} 2MgO$,参加反应的镁、氧气与生成的氧化镁的质量比为 $48:32:80$。24g镁完全反应需16g氧气,生成40g氧化镁,A错误。
B. 聚乙烯燃烧生成二氧化碳和水,只能说明含碳、氢元素,氧元素可能来自氧气,B错误。
C. 酒精与水混合是物理变化,质量守恒定律适用于化学变化,C错误。
D. 硫与氧气反应的化学方程式为 $S + O_2 \stackrel{点燃}{=\!=\!=} SO_2$,参加反应的硫、氧气与生成的二氧化硫的质量比为 $32:32:64 = 1:1:2$,1g硫与1g氧气恰好完全反应生成2g二氧化硫,D正确。
结论:D
A. 镁与氧气反应的化学方程式为 $2Mg + O_2 \stackrel{点燃}{=\!=\!=} 2MgO$,参加反应的镁、氧气与生成的氧化镁的质量比为 $48:32:80$。24g镁完全反应需16g氧气,生成40g氧化镁,A错误。
B. 聚乙烯燃烧生成二氧化碳和水,只能说明含碳、氢元素,氧元素可能来自氧气,B错误。
C. 酒精与水混合是物理变化,质量守恒定律适用于化学变化,C错误。
D. 硫与氧气反应的化学方程式为 $S + O_2 \stackrel{点燃}{=\!=\!=} SO_2$,参加反应的硫、氧气与生成的二氧化硫的质量比为 $32:32:64 = 1:1:2$,1g硫与1g氧气恰好完全反应生成2g二氧化硫,D正确。
结论:D
6. 如图是某反应的微观示意图,下列说法正确的是 (
A.W中碳元素的化合价为-4
B.参加反应的X、Y的分子个数比为1:1
C.反应前后各原子的种类发生改变
D.参加反应的X、Y的质量比等于生成的Z、W的质量比
A
)A.W中碳元素的化合价为-4
B.参加反应的X、Y的分子个数比为1:1
C.反应前后各原子的种类发生改变
D.参加反应的X、Y的质量比等于生成的Z、W的质量比
答案:A
解析:由图示可知,发生反应的化学方程式为 $ 3C + 4NH_3 \xlongequal[高温]{催化剂} 2N_2 + 3CH_4 $,W 为甲烷 $ (CH_4) $,甲烷中氢元素的化合价为 +1,根据化合物中各元素的正、负化合价的代数和为 0 可得,甲烷中碳元素的化合价为 -4,A 正确;由反应的化学方程式可知,参加反应的 X、Y 的分子个数比为 3:4,B 错误;根据质量守恒定律可知,化学反应前后原子的种类不变,C 错误;参加反应的 X、Y 的质量比为 $ (3 × 12) : (4 × 17) = 9 : 17 $,生成的 Z、W 的质量比为 $ (2 × 28) : (3 × 16) = 7 : 6 $,两者不相等,D 错误。故本题选 A。
解析:由图示可知,发生反应的化学方程式为 $ 3C + 4NH_3 \xlongequal[高温]{催化剂} 2N_2 + 3CH_4 $,W 为甲烷 $ (CH_4) $,甲烷中氢元素的化合价为 +1,根据化合物中各元素的正、负化合价的代数和为 0 可得,甲烷中碳元素的化合价为 -4,A 正确;由反应的化学方程式可知,参加反应的 X、Y 的分子个数比为 3:4,B 错误;根据质量守恒定律可知,化学反应前后原子的种类不变,C 错误;参加反应的 X、Y 的质量比为 $ (3 × 12) : (4 × 17) = 9 : 17 $,生成的 Z、W 的质量比为 $ (2 × 28) : (3 × 16) = 7 : 6 $,两者不相等,D 错误。故本题选 A。