8. 核电荷数为94的钚(Pu)是一种核原料,该元素的一种原子的相对原子质量为239,下列关于该原子的说法不正确的是 (
A.中子数为145
B.核外电子数为94
C.质子数为94
D.质子数与核外电子数之和为239
D
)A.中子数为145
B.核外电子数为94
C.质子数为94
D.质子数与核外电子数之和为239
答案:D
解析:
解:在原子中,核电荷数=质子数=核外电子数,相对原子质量≈质子数+中子数。
质子数=核电荷数=94,C正确;
核外电子数=质子数=94,B正确;
中子数=相对原子质量-质子数=239-94=145,A正确;
质子数与核外电子数之和=94+94=188≠239,D错误。
答案:D
质子数=核电荷数=94,C正确;
核外电子数=质子数=94,B正确;
中子数=相对原子质量-质子数=239-94=145,A正确;
质子数与核外电子数之和=94+94=188≠239,D错误。
答案:D
9. 下列关于原子核的叙述中,正确的是 (
① 通常由中子和电子构成 ② 通常由质子和中子构成 ③ 带正电荷 ④ 不显电性 ⑤ 不能再分 ⑥ 体积大约相当于原子的体积 ⑦ 质量大约相当于原子的质量
A.③④
B.②⑥⑦
C.①⑤
D.②③⑦
D
)① 通常由中子和电子构成 ② 通常由质子和中子构成 ③ 带正电荷 ④ 不显电性 ⑤ 不能再分 ⑥ 体积大约相当于原子的体积 ⑦ 质量大约相当于原子的质量
A.③④
B.②⑥⑦
C.①⑤
D.②③⑦
答案:D
解析:
原子核通常由质子和中子构成(②正确,①错误);质子带正电,中子不带电,故原子核带正电荷(③正确,④错误);原子核在化学变化中不能再分,但在核反应中可分(⑤错误);原子核体积很小,远小于原子体积(⑥错误);电子质量很小可忽略,原子核质量大约相当于原子的质量(⑦正确)。综上,正确的是②③⑦。
答案:D
答案:D
10. 如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同微观粒子。下列说法正确的是 (
A.决定该原子种类的微观粒子是b
B.原子中a与b的数目一定相同
C.原子中a与c的数目一定相同
D.原子的质量集中在a和b上
B
)A.决定该原子种类的微观粒子是b
B.原子中a与b的数目一定相同
C.原子中a与c的数目一定相同
D.原子的质量集中在a和b上
答案:B
解析:
解:由图可知,a为质子(带正电),b为电子(带负电),c为中子(不带电)。
A. 决定原子种类的是质子数(a),A错误;
B. 原子呈电中性,质子数(a)等于电子数(b),B正确;
C. 质子数(a)与中子数(c)不一定相同,C错误;
D. 原子质量集中在原子核(a和c)上,D错误。
答案:B
A. 决定原子种类的是质子数(a),A错误;
B. 原子呈电中性,质子数(a)等于电子数(b),B正确;
C. 质子数(a)与中子数(c)不一定相同,C错误;
D. 原子质量集中在原子核(a和c)上,D错误。
答案:B
11. (2024·盐城期中)科学家在实验中思考探索,逐步完善人类对原子内部结构的认识。
(1) α粒子是某些放射性物质衰变时放射出来的氦原子核,由两个中子和两个质子构成,则α粒子带两个单位的
(2) 科学家卢瑟福用平行高速运动的α粒子束轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现如图所示的三种现象:① 大多数α粒子不改变原来的运动方向;② 一小部分α粒子
A. 原子核的体积较大 B. 原子内部有很大的空间
C. 原子是一个实心球体 D. 原子核与α粒子带有相同的电荷
(3) 卢瑟福提出“除非原子的大部分质量集中到了一个很小的结构上”,这里的“很小的结构”是指原子中的
(4) 通过了解原子结构模型的建立过程,你能得出哪些结论?
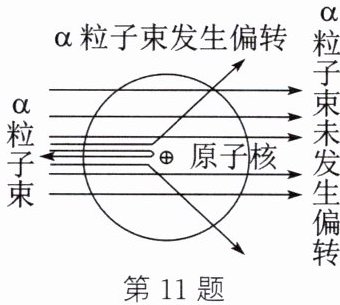
(1) α粒子是某些放射性物质衰变时放射出来的氦原子核,由两个中子和两个质子构成,则α粒子带两个单位的
正
电荷。(2) 科学家卢瑟福用平行高速运动的α粒子束轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现如图所示的三种现象:① 大多数α粒子不改变原来的运动方向;② 一小部分α粒子
改变了原来的运动方向
;③ 极少数α粒子被弹了回来
。由此可推出下列关于原子内部结构的一些假设,正确的是BD
。A. 原子核的体积较大 B. 原子内部有很大的空间
C. 原子是一个实心球体 D. 原子核与α粒子带有相同的电荷
(3) 卢瑟福提出“除非原子的大部分质量集中到了一个很小的结构上”,这里的“很小的结构”是指原子中的
原子核
。(4) 通过了解原子结构模型的建立过程,你能得出哪些结论?
科学模型在科学研究中起着重要作用(合理答案均可)
(写一点即可)。
答案:(1) 正 (2) ② 改变了原来的运动方向 ③ 被弹了回来 BD (3) 原子核 (4) 科学模型在科学研究中起着重要作用(合理答案均可)
12. 请回答下列问题。
(1) 相等数量的镁原子、铝原子,其质量比为
(2) 一个氧原子的质量为m kg,其相对原子质量为16,已知镁原子的相对原子质量为24,则一个镁原子的质量为
(3) 已知某原子的实际质量为a kg,相对原子质量为n,另一种原子的实际质量为b kg,则该种原子的相对原子质量为
(1) 相等数量的镁原子、铝原子,其质量比为
8:9
;等质量的金属镁、铝中含有的镁、铝原子的个数比为9:8
。(填最简整数比)(2) 一个氧原子的质量为m kg,其相对原子质量为16,已知镁原子的相对原子质量为24,则一个镁原子的质量为
1.5m
kg。(3) 已知某原子的实际质量为a kg,相对原子质量为n,另一种原子的实际质量为b kg,则该种原子的相对原子质量为
$\frac{bn}{a}$
。答案:(1) $8:9$ $9:8$ (2) $1.5m$ (3) $\frac{bn}{a}$ 解析: (1) 相等数量的镁原子和铝原子, 其质量比等于相对原子质量比, 故等于 $24:27 = 8:9$; 原子的个数 = $\frac{\text{物质的质量}}{\text{每个原子的实际质量}}$, 原子的实际质量与相对原子质量成正比, 计算过程中可利用相对原子质量代替原子的质量, 设两种金属的质量为 $k$, 则二者原子个数比为 $\frac{k}{24}:\frac{k}{27} = 9:8$。(2) 设一个镁原子的质量为 $x$, 则 $\frac{m \text{ kg}}{16} = \frac{x}{24}$, $x = 1.5m \text{ kg}$。(3) 设该种原子的相对原子质量为 $y$, 则 $\frac{a \text{ kg}}{b \text{ kg}} = \frac{n}{y}$, $y = \frac{bn}{a}$
解析:
(1) 8:9;9:8
(2) 1.5m
(3) $\frac{bn}{a}$
(2) 1.5m
(3) $\frac{bn}{a}$