9. 碳及其部分化合物的转化关系如图所示,其中X表示转化中的另一种反应物。下列说法中,错误的是 (

A.X可以是单质或氧化物
B.反应①中CO一定发生了氧化反应
C.反应③只能是碳酸钙与稀盐酸的反应
D.打开碳酸饮料瓶盖时会发生反应②
C
)
A.X可以是单质或氧化物
B.反应①中CO一定发生了氧化反应
C.反应③只能是碳酸钙与稀盐酸的反应
D.打开碳酸饮料瓶盖时会发生反应②
答案:C
解析:
解:
A. X可以是单质(如O₂,C+O₂$\frac{\underline{\;点燃\;}}{\;}$CO)或氧化物(如CO₂,C+CO₂$\frac{\underline{\;高温\;}}{\;}$2CO),正确。
B. 反应①中CO转化为CO₂,CO得氧,发生氧化反应,正确。
C. 反应③还可以是CO₂与Ca(OH)₂反应(CO₂+Ca(OH)₂=CaCO₃↓+H₂O),并非只能是碳酸钙与稀盐酸反应,错误。
D. 打开碳酸饮料瓶盖时,H₂CO₃分解为CO₂和H₂O,发生反应②,正确。
结论:错误的是C。
答案:C
A. X可以是单质(如O₂,C+O₂$\frac{\underline{\;点燃\;}}{\;}$CO)或氧化物(如CO₂,C+CO₂$\frac{\underline{\;高温\;}}{\;}$2CO),正确。
B. 反应①中CO转化为CO₂,CO得氧,发生氧化反应,正确。
C. 反应③还可以是CO₂与Ca(OH)₂反应(CO₂+Ca(OH)₂=CaCO₃↓+H₂O),并非只能是碳酸钙与稀盐酸反应,错误。
D. 打开碳酸饮料瓶盖时,H₂CO₃分解为CO₂和H₂O,发生反应②,正确。
结论:错误的是C。
答案:C
10. 节能减排中“减排”的关键是减少$CO_2$的排放,而“减排”的重要手段是合理利用$CO_2。$科学家利用$CO_2$为原料制取炭黑的流程如图。下列说法中,错误的是 (
A.过程2的变化中太阳能转化为化学能
B.过程1和过程2的变化都属于分解反应
C.此流程中有炭黑生成,还有氧气生成
D.此流程还需要解决炭黑和$Fe_3O_4$的分离问题
B
)A.过程2的变化中太阳能转化为化学能
B.过程1和过程2的变化都属于分解反应
C.此流程中有炭黑生成,还有氧气生成
D.此流程还需要解决炭黑和$Fe_3O_4$的分离问题
答案:B
解析:
解:
A. 过程2利用太阳能将$Fe_3O_4$转化为$FeO$和$O_2$,太阳能转化为化学能,正确。
B. 过程1:$CO_2 + 6FeO \xlongequal{430^{\circ}C} C + 2Fe_3O_4$,反应物两种,不属于分解反应;过程2:$2Fe_3O_4 \xlongequal{>2030^{\circ}C,\text{太阳能}} 6FeO + O_2\uparrow$,属于分解反应,错误。
C. 过程1生成炭黑(C),过程2生成$O_2$,正确。
D. 过程1生成炭黑和$Fe_3O_4$,需分离二者,正确。
答案:B
A. 过程2利用太阳能将$Fe_3O_4$转化为$FeO$和$O_2$,太阳能转化为化学能,正确。
B. 过程1:$CO_2 + 6FeO \xlongequal{430^{\circ}C} C + 2Fe_3O_4$,反应物两种,不属于分解反应;过程2:$2Fe_3O_4 \xlongequal{>2030^{\circ}C,\text{太阳能}} 6FeO + O_2\uparrow$,属于分解反应,错误。
C. 过程1生成炭黑(C),过程2生成$O_2$,正确。
D. 过程1生成炭黑和$Fe_3O_4$,需分离二者,正确。
答案:B
11. (6分)同学们设计如图所示的实验探究二氧化碳的性质,请你参与探究并回答下列问题:

(1) 实验1:如图甲所示,两个量筒中,一个充满$CO_2,$一个充满空气。充满$CO_2$的量筒是
(2) 实验2:如图乙所示,向一个收集满二氧化碳气体的软塑料瓶中加入约三分之一体积的水,立即旋紧瓶盖振荡,可观察到的实验现象是
(3) 实验3:如图丙所示,其设计的目的是

(1) 实验1:如图甲所示,两个量筒中,一个充满$CO_2,$一个充满空气。充满$CO_2$的量筒是
B
(填“A”或“B”),说明二氧化碳具有的性质是密度比空气大
。(2) 实验2:如图乙所示,向一个收集满二氧化碳气体的软塑料瓶中加入约三分之一体积的水,立即旋紧瓶盖振荡,可观察到的实验现象是
软塑料瓶变瘪(或变形)
,发生该变化的原因是部分 CO₂溶于水(或与水反应)使瓶内气体减少,气压减小,大气压强使软塑料瓶变瘪
。(3) 实验3:如图丙所示,其设计的目的是
验证二氧化碳能与水反应
。一段时间后,观察到Y形管右侧湿润的紫色石蕊试纸变红,写出发生反应的化学方程式:H₂O + CO₂ = H₂CO₃
。答案:(1)B 密度比空气大 (2)软塑料瓶变瘪(或变形)部分 CO₂溶于水(或与水反应)使瓶内气体减少,气压减小,大气压强使软塑料瓶变瘪 (3)验证二氧化碳能与水反应 H₂O + CO₂ = H₂CO₃
12. (8分)煤是重要的能源,也是化工产品的生产原料。
(1) 随着煤、石油等
(2) 乌黑的煤炭经过化学加工合成天然气的工艺流程如图甲。
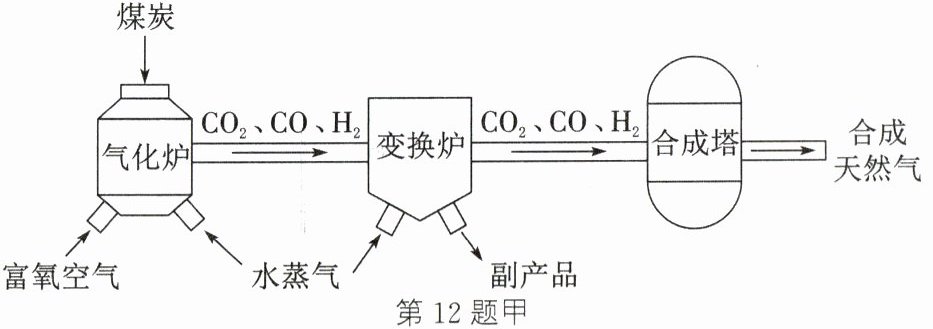
① 为使煤炭在气化炉中充分反应,可以进行的操作是
② 一定条件下,经变换炉反应后,CO含量降低,则气体含量增加的是
③ 合成天然气(CH₄)完全燃烧的化学方程式是
(3) 一定条件下,将上述气化炉制得的氢气与氮气反应生成氨气,氨气进一步氧化为NO,进而可生产硝酸。
① 氮气通常用分离液态空气法获得:在压强为101kPa时,液态氮的沸点是-196℃,液态氧的沸点是-183℃,则随温度升高先逸出的气体是
② 17gNH₃与
③ 如图乙是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值,曲线表示生产实际情况。当氨氧化率达到100%,理论上$y[ \frac{n(O_2)}{n(NH_3)} ]= 1.25,$实际生产要将y值维持在1.7~2.2之间,原因是
(1) 随着煤、石油等
不可再生
能源大量消耗,开发更多的新能源显得相当重要。试列举一项新能源:太阳能(合理答案均可)
。(2) 乌黑的煤炭经过化学加工合成天然气的工艺流程如图甲。

① 为使煤炭在气化炉中充分反应,可以进行的操作是
将煤炭粉碎(合理答案均可)
。② 一定条件下,经变换炉反应后,CO含量降低,则气体含量增加的是
CO₂和 H₂
。③ 合成天然气(CH₄)完全燃烧的化学方程式是
CH₄ + 2O₂ $\xlongequal{点燃}$ CO₂ + 2H₂O
。(3) 一定条件下,将上述气化炉制得的氢气与氮气反应生成氨气,氨气进一步氧化为NO,进而可生产硝酸。
① 氮气通常用分离液态空气法获得:在压强为101kPa时,液态氮的沸点是-196℃,液态氧的沸点是-183℃,则随温度升高先逸出的气体是
氮气
。② 17gNH₃与
63
gHNO₃具有相同质量的氮。③ 如图乙是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值,曲线表示生产实际情况。当氨氧化率达到100%,理论上$y[ \frac{n(O_2)}{n(NH_3)} ]= 1.25,$实际生产要将y值维持在1.7~2.2之间,原因是
氧气太少不利于 NH₃的转化,增大氧气的量,利于氨气的转化,y 值为 2.2 时氨氧化率已接近 100%
。答案:(1)不可再生 太阳能(合理答案均可) (2)①将煤炭粉碎(合理答案均可) ②CO₂和 H₂ ③CH₄ + 2O₂ $\xlongequal{点燃}$ CO₂ + 2H₂O (3)①氮气 ②63 ③氧气太少不利于 NH₃的转化,增大氧气的量,利于氨气的转化,y 值为 2.2 时氨氧化率已接近 100%