6. 在汽车上加装的催化转化器以钯、铂为催化剂,可以使汽车排放的有害气体一氧化氮和一氧化碳相互作用转化为空气中的两种成分。反应的化学方程式是
$2NO + 2CO\overset{催化剂}{=}N_{2} + 2CO_{2}$
。答案:【解析】:本题考查的是化学方程式的书写,特别是关于一氧化氮和一氧化碳在催化剂作用下转化为空气中两种成分的反应。根据质量守恒定律,反应前后元素的种类不变,因此可以推断出反应产物为氮气和二氧化碳。接下来,我们需要配平这个化学方程式,确保反应物和生成物的原子数量相等。
【答案】:$2NO + 2CO\overset{催化剂}{=}N_{2} + 2CO_{2}$。
【答案】:$2NO + 2CO\overset{催化剂}{=}N_{2} + 2CO_{2}$。
7. 实验室用高锰酸钾制取9.6 g氧气,至少需要高锰酸钾多少克?
答案:【解析】:
本题考查了利用化学方程式进行简单计算的知识点。
首先,写出高锰酸钾分解的化学方程式:$2KMnO_{4} \overset{\bigtriangleup}{=}K_{2}MnO_{4} + MnO_{2} + O_{2} \uparrow$。
在这个反应中,高锰酸钾是反应物,氧气是生成物之一。
设需要高锰酸钾的质量为x,则根据化学方程式,可以列出比例式:
$\frac{2 × 158}{32} = \frac{x}{9.6g}$,
其中,$2 × 158$是高锰酸钾的相对分子质量乘以化学计量数,32是氧气的相对分子质量。
解这个比例式,得到:
$x = \frac{2 × 158 × 9.6g}{32} = 94.8g$。
【答案】:
解:设至少需要高锰酸钾的质量为x。
$2KMnO_{4} \overset{\bigtriangleup}{=}K_{2}MnO_{4} + MnO_{2} + O_{2} \uparrow$,
$\frac{2 × 158}{32} = \frac{x}{9.6g}$,
解得:x=94.8g。
答:至少需要高锰酸钾94.8克。
本题考查了利用化学方程式进行简单计算的知识点。
首先,写出高锰酸钾分解的化学方程式:$2KMnO_{4} \overset{\bigtriangleup}{=}K_{2}MnO_{4} + MnO_{2} + O_{2} \uparrow$。
在这个反应中,高锰酸钾是反应物,氧气是生成物之一。
设需要高锰酸钾的质量为x,则根据化学方程式,可以列出比例式:
$\frac{2 × 158}{32} = \frac{x}{9.6g}$,
其中,$2 × 158$是高锰酸钾的相对分子质量乘以化学计量数,32是氧气的相对分子质量。
解这个比例式,得到:
$x = \frac{2 × 158 × 9.6g}{32} = 94.8g$。
【答案】:
解:设至少需要高锰酸钾的质量为x。
$2KMnO_{4} \overset{\bigtriangleup}{=}K_{2}MnO_{4} + MnO_{2} + O_{2} \uparrow$,
$\frac{2 × 158}{32} = \frac{x}{9.6g}$,
解得:x=94.8g。
答:至少需要高锰酸钾94.8克。
8. 某同学看到化学方程式$2Mg+O_2$点燃2MgO,想到以下两点。你还能想到更多吗?请把你的想法补充到下面空格中。
(1)镁条燃烧,放出耀眼白光和大量的热,生成白色粉末状氧化镁。
(2)反应前后组成物质的元素种类不变化,都含氧元素和镁元素。
(3)
(4)
(1)镁条燃烧,放出耀眼白光和大量的热,生成白色粉末状氧化镁。
(2)反应前后组成物质的元素种类不变化,都含氧元素和镁元素。
(3)
每2个镁原子和1个氧分子在点燃条件下反应生成2个氧化镁分子
。(4)
反应前后原子的种类和数目不变,镁原子、氧原子的个数均不变
。答案:(3)每2个镁原子和1个氧分子在点燃条件下反应生成2个氧化镁分子。
(4)反应前后原子的种类和数目不变,镁原子、氧原子的个数均不变。
(4)反应前后原子的种类和数目不变,镁原子、氧原子的个数均不变。
9. 学校研究性小组为了测定当地石灰石矿石中碳酸钙的质量分数,采集了一些矿石样品,并取盐酸200 g,将盐酸平均分成4等份,进行如下实验(杂质不与盐酸反应),结果如下表所示。
|实验|1|2|3|4|
|加入样品的质量/g|5|10|15|20|
|生成$CO_2$的质量/g|1.76|3.52|4.4|m|
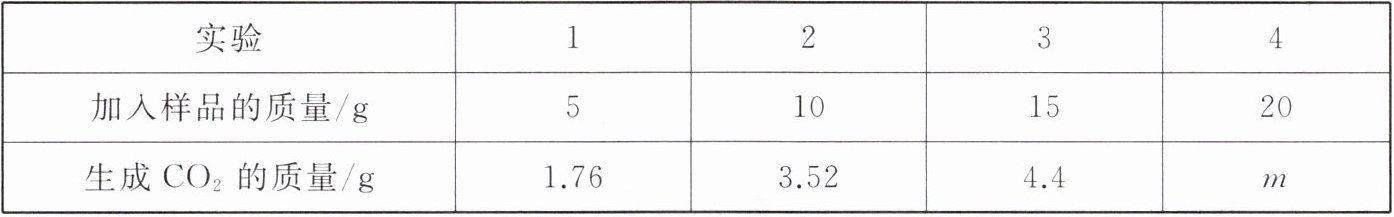
(1)哪几次反应中的碳酸钙有剩余?
(2)上表中m的数值是多少?
(3)这种石灰石矿石中碳酸钙的质量分数是多少?
|实验|1|2|3|4|
|加入样品的质量/g|5|10|15|20|
|生成$CO_2$的质量/g|1.76|3.52|4.4|m|

(1)哪几次反应中的碳酸钙有剩余?
(2)上表中m的数值是多少?
(3)这种石灰石矿石中碳酸钙的质量分数是多少?
答案:【解析】:
(1)根据表格中数据可知,第1次加入5g样品,生成二氧化碳的质量为1.76g;第2次加入10g样品,生成二氧化碳的质量为3.52g,说明每加入5g样品生成二氧化碳1.76g。那么第3次加入15g样品,若完全反应,生成二氧化碳的质量应为$1.76g×3 = 5.28g$,但实际生成4.4g,说明此时盐酸已完全反应,碳酸钙有剩余。第4次加入20g样品,盐酸量不变,所以碳酸钙也有剩余。
故答案为:3、4。
(2)由上述分析可知,第3次实验中盐酸已完全反应,后续再增加样品的质量,生成二氧化碳的质量也不再增加,所以$m = 4.4$。
故答案为:4.4。
(3)以第1次实验数据为例来计算石灰石矿石中碳酸钙的质量分数。设5g样品中碳酸钙的质量为$x$。
碳酸钙与盐酸反应的化学方程式为$CaCO_{3}+2HCl = CaCl_{2}+H_{2}O + CO_{2}\uparrow$。
根据化学方程式可知,碳酸钙与生成二氧化碳的质量比为$100:44$。
已知生成二氧化碳的质量为1.76g,则可列出比例式:
$\frac{100}{44}=\frac{x}{1.76g}$,
解得$x = 4g$。
这种石灰石矿石中碳酸钙的质量分数为$\frac{4g}{5g}×100\% = 80\%$。
【答案】:
(1)3、4;
(2)4.4;
(3)80%。
(1)根据表格中数据可知,第1次加入5g样品,生成二氧化碳的质量为1.76g;第2次加入10g样品,生成二氧化碳的质量为3.52g,说明每加入5g样品生成二氧化碳1.76g。那么第3次加入15g样品,若完全反应,生成二氧化碳的质量应为$1.76g×3 = 5.28g$,但实际生成4.4g,说明此时盐酸已完全反应,碳酸钙有剩余。第4次加入20g样品,盐酸量不变,所以碳酸钙也有剩余。
故答案为:3、4。
(2)由上述分析可知,第3次实验中盐酸已完全反应,后续再增加样品的质量,生成二氧化碳的质量也不再增加,所以$m = 4.4$。
故答案为:4.4。
(3)以第1次实验数据为例来计算石灰石矿石中碳酸钙的质量分数。设5g样品中碳酸钙的质量为$x$。
碳酸钙与盐酸反应的化学方程式为$CaCO_{3}+2HCl = CaCl_{2}+H_{2}O + CO_{2}\uparrow$。
根据化学方程式可知,碳酸钙与生成二氧化碳的质量比为$100:44$。
已知生成二氧化碳的质量为1.76g,则可列出比例式:
$\frac{100}{44}=\frac{x}{1.76g}$,
解得$x = 4g$。
这种石灰石矿石中碳酸钙的质量分数为$\frac{4g}{5g}×100\% = 80\%$。
【答案】:
(1)3、4;
(2)4.4;
(3)80%。