1. 下列有关二氧化碳的检验、制备和用途的说法正确的是(
A.干冰可用于人工增雨
B.二氧化碳气体通入紫色石蕊溶液中,试液变蓝
C.检验二氧化碳的方法是将该气体通入酚酞溶液
D.将燃着的木条伸入集气瓶,火焰立即熄灭,证明瓶内是二氧化碳
A
)。A.干冰可用于人工增雨
B.二氧化碳气体通入紫色石蕊溶液中,试液变蓝
C.检验二氧化碳的方法是将该气体通入酚酞溶液
D.将燃着的木条伸入集气瓶,火焰立即熄灭,证明瓶内是二氧化碳
答案:【解析】:
A选项:干冰是固态的二氧化碳,它升华时会吸收大量的热,使得空气中的水蒸气凝结成水滴,因此可以用于人工增雨。这是干冰的一个重要应用,所以A选项是正确的。
B选项:二氧化碳气体通入紫色石蕊溶液中,会与水反应生成碳酸,碳酸是一种弱酸,它能使紫色石蕊溶液变红,而不是变蓝。所以B选项是错误的。
C选项:检验二氧化碳的常用方法是将该气体通入澄清的石灰水中,如果石灰水变浑浊,说明该气体是二氧化碳。而酚酞溶液是用来检验碱的,遇到碱会变红,遇到酸或中性物质则不变色,所以C选项是错误的。
D选项:将燃着的木条伸入集气瓶,火焰立即熄灭,这只能证明瓶内的气体不支持燃烧,但不能确定就是二氧化碳,因为氮气等气体也不支持燃烧。所以D选项是错误的。
【答案】:A
A选项:干冰是固态的二氧化碳,它升华时会吸收大量的热,使得空气中的水蒸气凝结成水滴,因此可以用于人工增雨。这是干冰的一个重要应用,所以A选项是正确的。
B选项:二氧化碳气体通入紫色石蕊溶液中,会与水反应生成碳酸,碳酸是一种弱酸,它能使紫色石蕊溶液变红,而不是变蓝。所以B选项是错误的。
C选项:检验二氧化碳的常用方法是将该气体通入澄清的石灰水中,如果石灰水变浑浊,说明该气体是二氧化碳。而酚酞溶液是用来检验碱的,遇到碱会变红,遇到酸或中性物质则不变色,所以C选项是错误的。
D选项:将燃着的木条伸入集气瓶,火焰立即熄灭,这只能证明瓶内的气体不支持燃烧,但不能确定就是二氧化碳,因为氮气等气体也不支持燃烧。所以D选项是错误的。
【答案】:A
2. 下列区分一些常见物质时所用的试剂或方法正确的是(
A.氧气和氮气——闻气味
B.空气和人呼出的气体——澄清石灰水
C.氧气和氮气——紫色石蕊溶液
D.氮气和二氧化碳——燃着的小木条
B
)。A.氧气和氮气——闻气味
B.空气和人呼出的气体——澄清石灰水
C.氧气和氮气——紫色石蕊溶液
D.氮气和二氧化碳——燃着的小木条
答案:【解析】:
A选项:氧气和氮气都是无色无味的气体,因此通过闻气味无法区分它们。故A选项错误。
B选项:人呼出的气体中二氧化碳含量较高,能使澄清石灰水变浑浊,而空气中的二氧化碳含量较低,不能使澄清石灰水变浑浊。因此,通过澄清石灰水可以区分空气和人呼出的气体。故B选项正确。
C选项:氧气不易溶于水且不能使紫色石蕊溶液变色,氮气难溶于水且也不能使紫色石蕊溶液变色。因此,通过紫色石蕊溶液无法区分氧气和氮气。故C选项错误。
D选项:氮气和二氧化碳都不支持燃烧,因此燃着的小木条在氮气和二氧化碳中都会熄灭,无法区分它们。故D选项错误。
【答案】:B
A选项:氧气和氮气都是无色无味的气体,因此通过闻气味无法区分它们。故A选项错误。
B选项:人呼出的气体中二氧化碳含量较高,能使澄清石灰水变浑浊,而空气中的二氧化碳含量较低,不能使澄清石灰水变浑浊。因此,通过澄清石灰水可以区分空气和人呼出的气体。故B选项正确。
C选项:氧气不易溶于水且不能使紫色石蕊溶液变色,氮气难溶于水且也不能使紫色石蕊溶液变色。因此,通过紫色石蕊溶液无法区分氧气和氮气。故C选项错误。
D选项:氮气和二氧化碳都不支持燃烧,因此燃着的小木条在氮气和二氧化碳中都会熄灭,无法区分它们。故D选项错误。
【答案】:B
3. 下图①~④为常见的气体发生装置。下列说法正确的是(
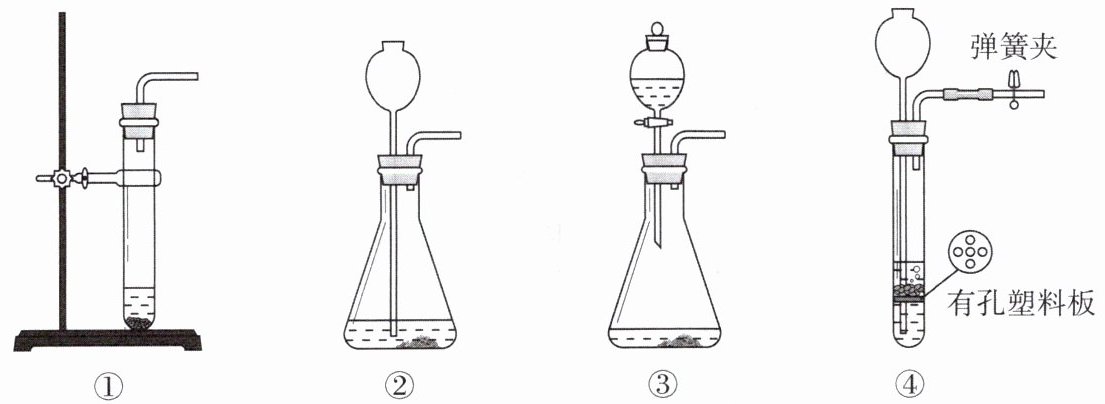
A.装置①~④都不能控制反应的速率
B.装置②可以方便地控制反应的开始与结束
C.装置①~④都可用于实验室制取二氧化碳气体
D.装置④可以控制反应的速率
D
)。
A.装置①~④都不能控制反应的速率
B.装置②可以方便地控制反应的开始与结束
C.装置①~④都可用于实验室制取二氧化碳气体
D.装置④可以控制反应的速率
答案:【解析】:
A选项:装置④通过分液漏斗可以控制液体的滴加速度,从而控制反应的速率,所以A选项错误。
B选项:装置②虽然可以通过长颈漏斗添加液体,但不能像装置④那样通过控制固体和液体的接触与分离来方便地控制反应的开始与结束,所以B选项错误。
C选项:实验室制取二氧化碳常用大理石(或石灰石)和稀盐酸反应,该反应是固体和液体在常温下进行的。装置③中长颈漏斗的下端没有伸入液面以下,会导致生成的二氧化碳从长颈漏斗中逸出,所以装置③不能用于实验室制取二氧化碳,C选项错误。
D选项:装置④中分液漏斗能控制液体的滴加速度,从而控制反应的速率,D选项正确。
【答案】:D
A选项:装置④通过分液漏斗可以控制液体的滴加速度,从而控制反应的速率,所以A选项错误。
B选项:装置②虽然可以通过长颈漏斗添加液体,但不能像装置④那样通过控制固体和液体的接触与分离来方便地控制反应的开始与结束,所以B选项错误。
C选项:实验室制取二氧化碳常用大理石(或石灰石)和稀盐酸反应,该反应是固体和液体在常温下进行的。装置③中长颈漏斗的下端没有伸入液面以下,会导致生成的二氧化碳从长颈漏斗中逸出,所以装置③不能用于实验室制取二氧化碳,C选项错误。
D选项:装置④中分液漏斗能控制液体的滴加速度,从而控制反应的速率,D选项正确。
【答案】:D
4. 一种以二氧化碳为原料生产炭黑的物质转化如右图所示,下列说法不正确的是(
A.整个循环过程可将$CO_2$转化为C和$O_2$
B.反应Ⅱ发生后,碳元素化合价降低
C.反应Ⅱ中,FeO与C的质量比为18∶1
D.反应Ⅰ发生后,固体物质所含铁元素的质量分数变大
C
)。A.整个循环过程可将$CO_2$转化为C和$O_2$
B.反应Ⅱ发生后,碳元素化合价降低
C.反应Ⅱ中,FeO与C的质量比为18∶1
D.反应Ⅰ发生后,固体物质所含铁元素的质量分数变大
答案:【解析】:
A选项:根据图中的物质转化关系,反应Ⅰ中$Fe_3O_4$在大于2026.85°C且在太阳能作用下分解为$FeO$和$O_2$,反应Ⅱ中$FeO$在426.85°C时与$CO_2$反应生成$C$和$Fe_3O_4$,整个循环过程可将$CO_2$转化为$C$和$O_2$,该选项正确。
B选项:反应Ⅱ中$CO_2$转化为$C$,$CO_2$中碳元素化合价为+4价,$C$单质中碳元素化合价为0价,碳元素化合价降低,该选项正确。
C选项:反应Ⅱ的化学方程式为$6FeO + CO_2 \xlongequal{426.85°C} 2Fe_3O_4 + C$,$FeO$的相对分子质量为$56 + 16 = 72$,$C$的相对原子质量为12,则$FeO$与$C$的质量比为$(6×72):12 = 36:1$,而不是18:1,该选项错误。
D选项:反应Ⅰ中$Fe_3O_4$分解为$FeO$和$O_2$,固体由$Fe_3O_4$变为$FeO$,$Fe_3O_4$中铁元素质量分数为$\frac{56×3}{56×3 + 16×4}×100\% \approx 72.4\%$,$FeO$中铁元素质量分数为$\frac{56}{56 + 16}×100\% \approx 77.8\%$,所以反应Ⅰ发生后,固体物质所含铁元素的质量分数变大,该选项正确。
【答案】:C
A选项:根据图中的物质转化关系,反应Ⅰ中$Fe_3O_4$在大于2026.85°C且在太阳能作用下分解为$FeO$和$O_2$,反应Ⅱ中$FeO$在426.85°C时与$CO_2$反应生成$C$和$Fe_3O_4$,整个循环过程可将$CO_2$转化为$C$和$O_2$,该选项正确。
B选项:反应Ⅱ中$CO_2$转化为$C$,$CO_2$中碳元素化合价为+4价,$C$单质中碳元素化合价为0价,碳元素化合价降低,该选项正确。
C选项:反应Ⅱ的化学方程式为$6FeO + CO_2 \xlongequal{426.85°C} 2Fe_3O_4 + C$,$FeO$的相对分子质量为$56 + 16 = 72$,$C$的相对原子质量为12,则$FeO$与$C$的质量比为$(6×72):12 = 36:1$,而不是18:1,该选项错误。
D选项:反应Ⅰ中$Fe_3O_4$分解为$FeO$和$O_2$,固体由$Fe_3O_4$变为$FeO$,$Fe_3O_4$中铁元素质量分数为$\frac{56×3}{56×3 + 16×4}×100\% \approx 72.4\%$,$FeO$中铁元素质量分数为$\frac{56}{56 + 16}×100\% \approx 77.8\%$,所以反应Ⅰ发生后,固体物质所含铁元素的质量分数变大,该选项正确。
【答案】:C
5. 目前$,CO_2$捕集技术的关键是将$CO_2$从排放物中分离出来。分离方法主要分为物理吸收法和化学吸收法。物理吸收法中的一种是用甲醇作溶剂进行吸收;另一种是用活性炭、沸石等对$CO_2$进行吸附性吸收。化学吸收法中的吸收剂主要有氨水等。用氨水$(NH_3·H_2O)$吸收时,控制温度在30℃左右,采用喷氨技术吸收$CO_2,$生成碳酸氢铵$(NH_4HCO_3)。$高效的$CO_2$捕集和封存技术,会为我国在2060年实现碳中和的目标作出巨大贡献。
(1) 用氨水$(NH_3·H_2O)$吸收$CO_2$生成$NH_4HCO_3$的化学方程式是
(2) 活性炭、沸石等可作吸附剂,则其可能具备的结构特点是
(3) 下列措施有利于实现“碳中和”目标的是
a. 发展风力发电,减少燃煤发电
b. 大力发展城市燃油公交以提升运力
c. 安装太阳能热水器,减少燃气热水器的使用
(1) 用氨水$(NH_3·H_2O)$吸收$CO_2$生成$NH_4HCO_3$的化学方程式是
$NH_3 \cdot H_2O + CO_2 = NH_4HCO_3$
。(2) 活性炭、沸石等可作吸附剂,则其可能具备的结构特点是
疏松多孔
。(3) 下列措施有利于实现“碳中和”目标的是
ac
(填字母)。a. 发展风力发电,减少燃煤发电
b. 大力发展城市燃油公交以提升运力
c. 安装太阳能热水器,减少燃气热水器的使用
答案:【解析】:
(1) 本题考查化学方程式的书写。根据题目描述,氨水与二氧化碳反应生成碳酸氢铵,可以写出对应的化学方程式。
(2) 本题考查吸附剂的结构特点。活性炭和沸石作为吸附剂,其结构特点应具有疏松多孔的结构,以便吸附气体分子。
(3) 本题考查对“碳中和”目标的理解以及实现该目标的措施。碳中和是指通过节能减排、植树造林等方式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。因此,需要选择减少二氧化碳排放的措施。
a项:发展风力发电,减少燃煤发电,可以减少二氧化碳的排放,有利于实现碳中和目标。
b项:大力发展城市燃油公交以提升运力,会增加燃油的消耗,从而增加二氧化碳的排放,不利于实现碳中和目标。
c项:安装太阳能热水器,减少燃气热水器的使用,可以减少燃气的消耗,从而减少二氧化碳的排放,有利于实现碳中和目标。
【答案】:
(1) $NH_3 \cdot H_2O + CO_2 = NH_4HCO_3$
(2) 疏松多孔
(3) ac
(1) 本题考查化学方程式的书写。根据题目描述,氨水与二氧化碳反应生成碳酸氢铵,可以写出对应的化学方程式。
(2) 本题考查吸附剂的结构特点。活性炭和沸石作为吸附剂,其结构特点应具有疏松多孔的结构,以便吸附气体分子。
(3) 本题考查对“碳中和”目标的理解以及实现该目标的措施。碳中和是指通过节能减排、植树造林等方式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。因此,需要选择减少二氧化碳排放的措施。
a项:发展风力发电,减少燃煤发电,可以减少二氧化碳的排放,有利于实现碳中和目标。
b项:大力发展城市燃油公交以提升运力,会增加燃油的消耗,从而增加二氧化碳的排放,不利于实现碳中和目标。
c项:安装太阳能热水器,减少燃气热水器的使用,可以减少燃气的消耗,从而减少二氧化碳的排放,有利于实现碳中和目标。
【答案】:
(1) $NH_3 \cdot H_2O + CO_2 = NH_4HCO_3$
(2) 疏松多孔
(3) ac