1. 下列关于铁的说法错误的是(
A.我国古代已有成熟的炼铁工艺
B.铁是地壳中含量最多的金属元素
C.自然界中的铁主要以化合物形式存在
D.赤铁矿可用作工业炼铁的原料
B
)。A.我国古代已有成熟的炼铁工艺
B.铁是地壳中含量最多的金属元素
C.自然界中的铁主要以化合物形式存在
D.赤铁矿可用作工业炼铁的原料
答案:【解析】:
本题主要考察对铁及其相关知识的了解。
A选项:我国古代确实已有成熟的炼铁工艺,这是历史事实,所以A选项是正确的。
B选项:地壳中含量最多的金属元素实际上是铝,而非铁,所以B选项是错误的。
C选项:由于铁的化学性质较为活泼,它容易与其他元素结合形成化合物,所以在自然界中,铁主要以化合物的形式存在,C选项是正确的。
D选项:赤铁矿的主要成分是氧化铁,它是工业炼铁的重要原料,所以D选项也是正确的。
【答案】:B
本题主要考察对铁及其相关知识的了解。
A选项:我国古代确实已有成熟的炼铁工艺,这是历史事实,所以A选项是正确的。
B选项:地壳中含量最多的金属元素实际上是铝,而非铁,所以B选项是错误的。
C选项:由于铁的化学性质较为活泼,它容易与其他元素结合形成化合物,所以在自然界中,铁主要以化合物的形式存在,C选项是正确的。
D选项:赤铁矿的主要成分是氧化铁,它是工业炼铁的重要原料,所以D选项也是正确的。
【答案】:B
2. 下列变化过程不属于金属冶炼的是(
A.电解氧化铝得到金属铝
B.铁在氧气中发生燃烧
C.金属氧化物与焦炭在高温下反应
D.高温下 CO 还原CuO
B
)。A.电解氧化铝得到金属铝
B.铁在氧气中发生燃烧
C.金属氧化物与焦炭在高温下反应
D.高温下 CO 还原CuO
答案:【解析】:
本题考察的是金属冶炼的相关知识。金属冶炼是指将金属从化合态转变成游离态的过程。我们需要分析每个选项,看其是否符合金属冶炼的定义。
A选项描述的是电解氧化铝得到金属铝,这是一个典型的金属冶炼过程,因为铝是从其化合物(氧化铝)中被提炼出来的。
B选项描述的是铁在氧气中燃烧,这是一个化学反应,但并不是金属冶炼,因为在这个过程中,铁并没有从化合态转变为游离态,反而是从游离态(铁单质)变为了化合态(铁的氧化物)。
C选项描述的是金属氧化物与焦炭在高温下反应,这通常是一个金属冶炼的过程,因为焦炭可以作为还原剂,将金属从其氧化物中还原出来。
D选项描述的是高温下CO还原CuO,这也是一个金属冶炼的过程,因为CO作为还原剂,将Cu从其氧化物中还原出来。
【答案】:B
本题考察的是金属冶炼的相关知识。金属冶炼是指将金属从化合态转变成游离态的过程。我们需要分析每个选项,看其是否符合金属冶炼的定义。
A选项描述的是电解氧化铝得到金属铝,这是一个典型的金属冶炼过程,因为铝是从其化合物(氧化铝)中被提炼出来的。
B选项描述的是铁在氧气中燃烧,这是一个化学反应,但并不是金属冶炼,因为在这个过程中,铁并没有从化合态转变为游离态,反而是从游离态(铁单质)变为了化合态(铁的氧化物)。
C选项描述的是金属氧化物与焦炭在高温下反应,这通常是一个金属冶炼的过程,因为焦炭可以作为还原剂,将金属从其氧化物中还原出来。
D选项描述的是高温下CO还原CuO,这也是一个金属冶炼的过程,因为CO作为还原剂,将Cu从其氧化物中还原出来。
【答案】:B
3. 利用右图所示实验装置模拟工业炼铁。下列说法正确的是(
A.反应前后 Fe元素的化合价由+2变为0
B.充分加热,a处固体由黑色变为红色
C.b处可以用澄清石灰水检验生成的$CO_2$
D.可用水吸收尾气中的一氧化碳
C
)。A.反应前后 Fe元素的化合价由+2变为0
B.充分加热,a处固体由黑色变为红色
C.b处可以用澄清石灰水检验生成的$CO_2$
D.可用水吸收尾气中的一氧化碳
答案:【解析】:
A选项:一氧化碳还原氧化铁的反应中,氧化铁中铁元素的化合价为+3价,反应后铁单质的化合价为0价,不是由+2变为0,该选项错误。
B选项:一氧化碳还原氧化铁,生成铁和二氧化碳,a处固体由红棕色变为黑色,不是由黑色变为红色,该选项错误。
C选项:二氧化碳能使澄清石灰水变浑浊,b处可以用澄清石灰水检验生成的$CO_2$,该选项正确。
D选项:一氧化碳难溶于水,不与水反应,不能用水吸收尾气中的一氧化碳,该选项错误。
【答案】:C
A选项:一氧化碳还原氧化铁的反应中,氧化铁中铁元素的化合价为+3价,反应后铁单质的化合价为0价,不是由+2变为0,该选项错误。
B选项:一氧化碳还原氧化铁,生成铁和二氧化碳,a处固体由红棕色变为黑色,不是由黑色变为红色,该选项错误。
C选项:二氧化碳能使澄清石灰水变浑浊,b处可以用澄清石灰水检验生成的$CO_2$,该选项正确。
D选项:一氧化碳难溶于水,不与水反应,不能用水吸收尾气中的一氧化碳,该选项错误。
【答案】:C
4. 炼铁的主要原料是下列物质中的(
①铁矿石 ②一氧化碳 ③焦炭 ④石灰石 ⑤孔雀石
A.①②④
B.①③④
C.③④⑤
D.①④⑤
B
)。①铁矿石 ②一氧化碳 ③焦炭 ④石灰石 ⑤孔雀石
A.①②④
B.①③④
C.③④⑤
D.①④⑤
答案:解:炼铁的主要原料包括铁矿石、焦炭和石灰石。铁矿石提供铁元素,焦炭的作用是提供热量和生成一氧化碳(还原剂),石灰石用于除去铁矿石中的杂质(脉石)。一氧化碳是反应过程中生成的还原剂,并非主要原料;孔雀石不是炼铁常用的原料。所以正确的原料组合是①③④。
答案:B
答案:B
5. 某同学在实验室用CO与$Fe_2O_3$加热反应,若得到5.6g铁,则整个实验过程用掉的CO质量为(
A.4.2g
B.小于4.2g
C.大于4.2g
D.无法判断
C
)。A.4.2g
B.小于4.2g
C.大于4.2g
D.无法判断
答案:解:设生成5.6g铁需要一氧化碳的质量为x。
Fe₂O₃ + 3CO $\xlongequal{\triangle}$ 2Fe + 3CO₂
84 112
x 5.6g
$\frac{84}{112} = \frac{x}{5.6g}$
x = 4.2g
实验中,CO需先通入排尽装置内空气,反应结束后需继续通入CO直至冷却,故实际用掉的CO质量大于4.2g。
答案:C
Fe₂O₃ + 3CO $\xlongequal{\triangle}$ 2Fe + 3CO₂
84 112
x 5.6g
$\frac{84}{112} = \frac{x}{5.6g}$
x = 4.2g
实验中,CO需先通入排尽装置内空气,反应结束后需继续通入CO直至冷却,故实际用掉的CO质量大于4.2g。
答案:C
6. 工业炼铁的主要设备是
高炉
,得到的是生铁
。答案:【解析】:
本题考查工业炼铁的基本知识。工业炼铁的主要设备是高炉,在高炉中通过还原铁矿石得到的是生铁,生铁是铁和碳的合金,含碳量较高。
【答案】:
高炉;生铁
本题考查工业炼铁的基本知识。工业炼铁的主要设备是高炉,在高炉中通过还原铁矿石得到的是生铁,生铁是铁和碳的合金,含碳量较高。
【答案】:
高炉;生铁
7. 同学们利用下页图装置进行一氧化碳还原氧化铁的实验。
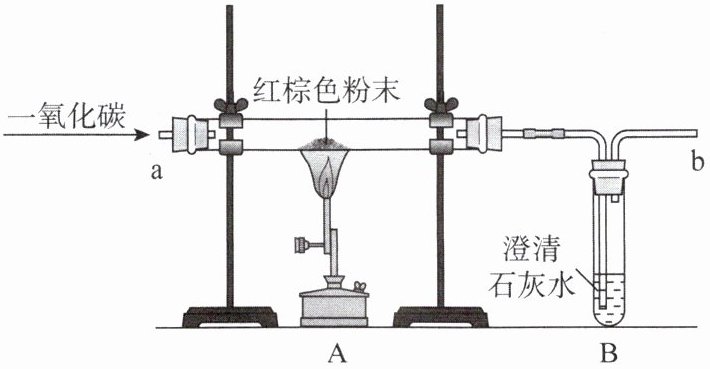
(1) 实验开始时,先进行
Ⅰ. 加热
Ⅱ. 通CO
(2) A中反应的化学方程式是
(3) 有一实验组同学完成实验后将得到的铁粉倒在白纸上,发现能被磁铁吸引,但同时看到白纸上冒火星,被烧出一个洞,吸到磁铁上的黑色粉末不一会儿又变红了,这是因为
(4) 由于CO

(1) 实验开始时,先进行
Ⅱ
(选填"Ⅰ"或"Ⅱ",后同),后进行 Ⅰ
。若违反顺序可能会发生 爆炸
。Ⅰ. 加热
Ⅱ. 通CO
(2) A中反应的化学方程式是
$3CO + Fe_{2}O_{3}\stackrel{高温}{=\!=\!=}2Fe + 3CO_{2}$
;B中观察到的现象是 澄清石灰水变浑浊
。(3) 有一实验组同学完成实验后将得到的铁粉倒在白纸上,发现能被磁铁吸引,但同时看到白纸上冒火星,被烧出一个洞,吸到磁铁上的黑色粉末不一会儿又变红了,这是因为
铁粉在空气中被氧化,重新生成了氧化铁
。(4) 由于CO
有毒
,故尾气要 点燃(或收集等合理答案)
处理。答案:【解析】:
(1) 一氧化碳还原氧化铁的实验中,由于一氧化碳是可燃性气体,与空气混合加热可能会发生爆炸,所以实验开始时要先通一氧化碳排尽装置内的空气,后加热,若违反顺序可能会发生爆炸。
(2) 一氧化碳还原氧化铁生成铁和二氧化碳,化学方程式为$3CO + Fe_{2}O_{3}\stackrel{高温}{=\!=\!=}2Fe + 3CO_{2}$;B中是二氧化碳与氢氧化钙反应,观察到的现象是澄清石灰水变浑浊。
(3) 得到的铁粉能被磁铁吸引,白纸上冒火星,被烧出一个洞,吸到磁铁上的黑色粉末不一会儿又变红了,是因为铁粉在空气中被氧化,重新生成了氧化铁,氧化铁是红棕色粉末。
(4) 一氧化碳有毒,会污染空气,所以尾气要进行处理。
【答案】:
(1) Ⅱ;Ⅰ;爆炸
(2) $3CO + Fe_{2}O_{3}\stackrel{高温}{=\!=\!=}2Fe + 3CO_{2}$;澄清石灰水变浑浊
(3) 铁粉在空气中被氧化,重新生成了氧化铁
(4) 有毒;点燃(或收集等合理答案)
(1) 一氧化碳还原氧化铁的实验中,由于一氧化碳是可燃性气体,与空气混合加热可能会发生爆炸,所以实验开始时要先通一氧化碳排尽装置内的空气,后加热,若违反顺序可能会发生爆炸。
(2) 一氧化碳还原氧化铁生成铁和二氧化碳,化学方程式为$3CO + Fe_{2}O_{3}\stackrel{高温}{=\!=\!=}2Fe + 3CO_{2}$;B中是二氧化碳与氢氧化钙反应,观察到的现象是澄清石灰水变浑浊。
(3) 得到的铁粉能被磁铁吸引,白纸上冒火星,被烧出一个洞,吸到磁铁上的黑色粉末不一会儿又变红了,是因为铁粉在空气中被氧化,重新生成了氧化铁,氧化铁是红棕色粉末。
(4) 一氧化碳有毒,会污染空气,所以尾气要进行处理。
【答案】:
(1) Ⅱ;Ⅰ;爆炸
(2) $3CO + Fe_{2}O_{3}\stackrel{高温}{=\!=\!=}2Fe + 3CO_{2}$;澄清石灰水变浑浊
(3) 铁粉在空气中被氧化,重新生成了氧化铁
(4) 有毒;点燃(或收集等合理答案)