8. 某兴趣小组对物质的性质进行相关探究。
[提出问题] 氯化氢(${HCl}$)气体显酸性吗?
[进行实验] 该兴趣小组的同学根据氯化氢与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成的蓝紫色纸质干燥小花分别进行如图1所示的三个实验:

[实验现象] Ⅰ和Ⅱ中小花不变色,Ⅲ中小花变为红色。

[查阅资料] 图2是同学们查阅的氯化氢气体溶于水的示意图。
[实验结论] 氯化氢气体不显酸性。
[交流反思]
(1)从微观角度分析氯化氢气体不显酸性的原因是
(2)小明向实验Ⅲ中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式:
(3)紫甘蓝的汁液在酸性溶液中显
(4)下列实验可以用来说明氯化氢气体不显酸性的是
A. 测试盐酸的导电性,盐酸能导电
B. 干燥的碳酸钠粉末放入氯化氢气体中,不反应
C. 氢气与氯气反应,生成氯化氢气体
D. 干燥的碳酸钠粉末放入盐酸中,能反应
[提出问题] 氯化氢(${HCl}$)气体显酸性吗?
[进行实验] 该兴趣小组的同学根据氯化氢与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成的蓝紫色纸质干燥小花分别进行如图1所示的三个实验:

[实验现象] Ⅰ和Ⅱ中小花不变色,Ⅲ中小花变为红色。

[查阅资料] 图2是同学们查阅的氯化氢气体溶于水的示意图。
[实验结论] 氯化氢气体不显酸性。
[交流反思]
(1)从微观角度分析氯化氢气体不显酸性的原因是
在氯化氢气体中,氯化氢以分子形式存在,没有解离出氢离子,所以氯化氢气体不显酸性
。(2)小明向实验Ⅲ中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式:
$\mathrm{NaOH} + \mathrm{HCl} \longrightarrow \mathrm{NaCl} + \mathrm{H}_2\mathrm{O}$
。(3)紫甘蓝的汁液在酸性溶液中显
红
色。(4)下列实验可以用来说明氯化氢气体不显酸性的是
B
(填字母序号)。A. 测试盐酸的导电性,盐酸能导电
B. 干燥的碳酸钠粉末放入氯化氢气体中,不反应
C. 氢气与氯气反应,生成氯化氢气体
D. 干燥的碳酸钠粉末放入盐酸中,能反应
答案:8.(1)在氯化氢气体中,氯化氢以分子形式存在,没有解离出氢离子,所以氯化氢气体不显酸性
$(2)\mathrm{NaOH} + \mathrm{HCl} \longrightarrow \mathrm{NaCl} + \mathrm{H}_2\mathrm{O} $
(3)红 (4)B
$(2)\mathrm{NaOH} + \mathrm{HCl} \longrightarrow \mathrm{NaCl} + \mathrm{H}_2\mathrm{O} $
(3)红 (4)B
9. 某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中残余的硫酸,共消耗氢氧化钠溶液80.0 g,洗涤后的溶液呈中性。这一定量石油产品中含${H_{2}SO_{4}}$的质量是多少?
答案:9.19.6g
解析:
解:设石油产品中含$H_{2}SO_{4}$的质量为$x$。
消耗氢氧化钠溶液中溶质的质量为:$80.0\ \mathrm{g} × 20\% = 16.0\ \mathrm{g}$
$2\mathrm{NaOH} + \mathrm{H}_{2}\mathrm{SO}_{4} = \mathrm{Na}_{2}\mathrm{SO}_{4} + 2\mathrm{H}_{2}\mathrm{O}$
$80$ $98$
$16.0\ \mathrm{g}$ $x$
$\frac{80}{98} = \frac{16.0\ \mathrm{g}}{x}$
$x = \frac{98 × 16.0\ \mathrm{g}}{80} = 19.6\ \mathrm{g}$
答:石油产品中含$H_{2}SO_{4}$的质量是$19.6\ \mathrm{g}$。
消耗氢氧化钠溶液中溶质的质量为:$80.0\ \mathrm{g} × 20\% = 16.0\ \mathrm{g}$
$2\mathrm{NaOH} + \mathrm{H}_{2}\mathrm{SO}_{4} = \mathrm{Na}_{2}\mathrm{SO}_{4} + 2\mathrm{H}_{2}\mathrm{O}$
$80$ $98$
$16.0\ \mathrm{g}$ $x$
$\frac{80}{98} = \frac{16.0\ \mathrm{g}}{x}$
$x = \frac{98 × 16.0\ \mathrm{g}}{80} = 19.6\ \mathrm{g}$
答:石油产品中含$H_{2}SO_{4}$的质量是$19.6\ \mathrm{g}$。
10. 化学小组以${NaOH}$为例,从定性和定量两个维度研究物质及其变化。
维度一:定性认识${NaOH}$及其溶液
(1)${NaOH}$属于“酸”或“碱”中的
(2)将${NaOH}$曝露在空气中,可观察到表面潮湿并逐渐溶解。该现象反映出${NaOH}$的性质有
(3)向稀${NaOH}$溶液中滴加酚酞溶液,振荡,可观察到溶液由无色变为
维度二:定量研究${NaOH}$溶液与不同物质的反应
Ⅰ. 酸碱度视角
25℃时,利用装置(图甲)测定${NaOH}$溶液与稀盐酸反应过程中pH的变化,测定结果如图乙所示(控制反应过程中温度不变)。
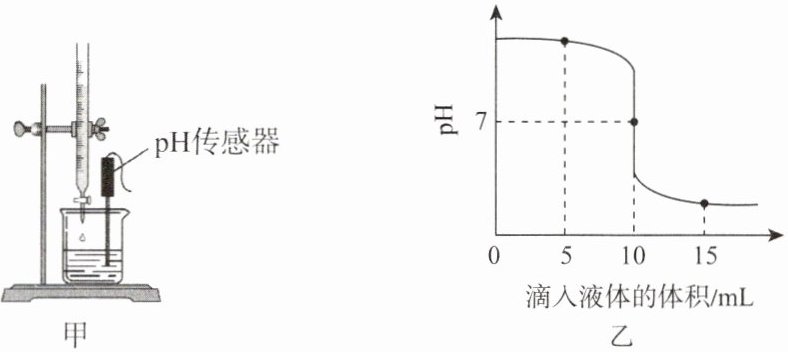
(4)烧杯中预先盛装的溶液是
(5)当滴入液体的体积为
Ⅱ. 能量视角
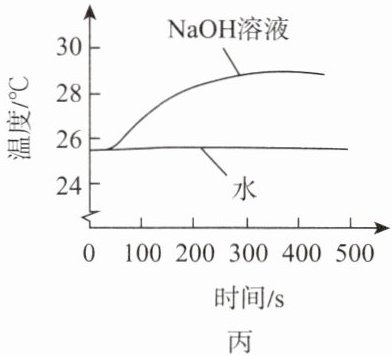
(6)利用传感器测定${NaOH}$溶液与${CO_{2}}$反应过程中温度的变化,测定结果如图丙所示,水为对照组。由图丙可知,${NaOH}$与${CO_{2}}$的反应属于
Ⅲ. 压强视角
[提出问题] 如何通过气体压强变化认识${NaOH}$溶液与${CO_{2}}$的反应?
[查阅资料]
① 可以通过反应物的减少或生成物的增加判断反应的发生情况;
② 影响密闭体系内气体压强的因素有气体分子数、气体所占体积和温度。
[实施实验] 利用气密性良好的装置(图丁)进行实验。打开压强传感器,待示数平稳后将水匀速注入充满${CO_{2}}$的集气瓶中,压强稳定后再匀速注入等体积的${NaOH}$溶液。测得气体压强变化如图戊所示。
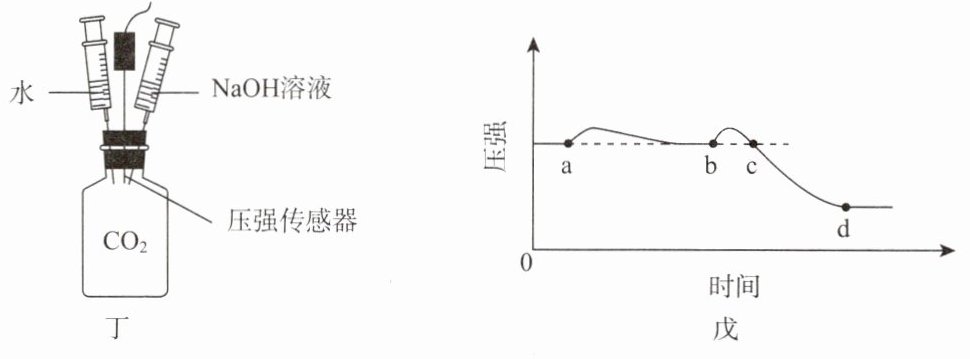
[分析并解释数据]
(7)对比a点、b点及
(8)结合b→c的变化过程,解释b点、c点压强相同的原因:
维度一:定性认识${NaOH}$及其溶液
(1)${NaOH}$属于“酸”或“碱”中的
碱
。(2)将${NaOH}$曝露在空气中,可观察到表面潮湿并逐渐溶解。该现象反映出${NaOH}$的性质有
易潮解(合理即可)
(答一条)。(3)向稀${NaOH}$溶液中滴加酚酞溶液,振荡,可观察到溶液由无色变为
红
色。维度二:定量研究${NaOH}$溶液与不同物质的反应
Ⅰ. 酸碱度视角
25℃时,利用装置(图甲)测定${NaOH}$溶液与稀盐酸反应过程中pH的变化,测定结果如图乙所示(控制反应过程中温度不变)。

(4)烧杯中预先盛装的溶液是
氢氧化钠溶液
。(5)当滴入液体的体积为
10
mL时,烧杯内溶液中的溶质只有${NaCl}$。Ⅱ. 能量视角
(6)利用传感器测定${NaOH}$溶液与${CO_{2}}$反应过程中温度的变化,测定结果如图丙所示,水为对照组。由图丙可知,${NaOH}$与${CO_{2}}$的反应属于
放热反应
(填“放热反应”或“吸热反应”)。
Ⅲ. 压强视角
[提出问题] 如何通过气体压强变化认识${NaOH}$溶液与${CO_{2}}$的反应?
[查阅资料]
① 可以通过反应物的减少或生成物的增加判断反应的发生情况;
② 影响密闭体系内气体压强的因素有气体分子数、气体所占体积和温度。
[实施实验] 利用气密性良好的装置(图丁)进行实验。打开压强传感器,待示数平稳后将水匀速注入充满${CO_{2}}$的集气瓶中,压强稳定后再匀速注入等体积的${NaOH}$溶液。测得气体压强变化如图戊所示。

[分析并解释数据]
(7)对比a点、b点及
d
点压强的大小,可证明${NaOH}$与${CO_{2}}$发生了反应。(8)结合b→c的变化过程,解释b点、c点压强相同的原因:
在b→c的变化过程中:注入$\mathrm{NaOH}$溶液,气体所占体积减小,压强增大;$\mathrm{CO}_2$与$\mathrm{NaOH}$溶液反应放热,温度升高,压强增大;$\mathrm{CO}_2$与$\mathrm{NaOH}$溶液反应,$\mathrm{CO}_2$分子数减少,压强减小。各种因素的影响相互抵消,b点与c点的压强相同。(合理即可)
。答案:10.(1)碱 (2)易潮解(合理即可) (3)红 (4)氢氧化钠溶液 (5)10 (6)放热反应 (7)d (8)在b→c的变化过程中:注入$\mathrm{NaOH}$溶液,气体所占体积减小,压强增大;$\mathrm{CO}_2$与$\mathrm{NaOH}$溶液反应放热,温度升高,压强增大;$\mathrm{CO}_2$与$\mathrm{NaOH}$溶液反应,$\mathrm{CO}_2$分子数减少,压强减小。各种因素的影响相互抵消,b点与c点的压强相同。(合理即可)