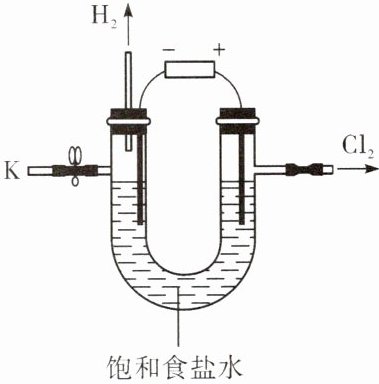
11. 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生了兴趣,在老师的指导下,用自制的实验装置(主体部分如右图所示)进行电解饱和食盐水制取氢氧化钠的实验。一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究。
[老师提示]
(1)电解饱和食盐水的反应的化学方程式:${2NaCl + 2H_{2}O\xlongequal{通电}2NaOH + H_{2}\uparrow + Cl_{2}\uparrow}$
(2)忽略其他可能发生的反应对以下实验的影响。
[实验探究]
探究一:检验待测液中是否含有氢氧化钠。
同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整。

探究二:测定待测液中氢氧化钠的质量分数。
实验一:用酸碱中和法测定。
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:

(1)写出氢氧化钠与稀盐酸反应的化学方程式:
(2)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应该选用稀盐酸的体积为
实验二:用沉淀法测定。
资料摘要:氢氧化钠与氯化镁溶液发生的反应的化学方程式为${2NaOH + MgCl_{2}\xlongequal{}Mg(OH)_{2}\downarrow + 2NaCl}$
乙组同学按如图所示的实验步骤进行实验:
(3)步骤②加入的氯化镁溶液必须足量,其目的是
(4)步骤③过滤出的沉淀物是
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定的氢氧化钠的质量分数将

[老师提示]
(1)电解饱和食盐水的反应的化学方程式:${2NaCl + 2H_{2}O\xlongequal{通电}2NaOH + H_{2}\uparrow + Cl_{2}\uparrow}$
(2)忽略其他可能发生的反应对以下实验的影响。
[实验探究]
探究一:检验待测液中是否含有氢氧化钠。
同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整。

探究二:测定待测液中氢氧化钠的质量分数。
实验一:用酸碱中和法测定。
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:

(1)写出氢氧化钠与稀盐酸反应的化学方程式:
$\mathrm{NaOH} + \mathrm{HCl} \longrightarrow \mathrm{NaCl} + \mathrm{H}_2\mathrm{O}$
。(2)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应该选用稀盐酸的体积为
9.8
mL。实验二:用沉淀法测定。
资料摘要:氢氧化钠与氯化镁溶液发生的反应的化学方程式为${2NaOH + MgCl_{2}\xlongequal{}Mg(OH)_{2}\downarrow + 2NaCl}$
乙组同学按如图所示的实验步骤进行实验:

(3)步骤②加入的氯化镁溶液必须足量,其目的是
使$\mathrm{NaOH}$完全反应
。滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,往上层澄清液体中继续滴加氯化镁溶液,若无白色沉淀生成,说明所加氯化镁溶液已足量(或其他合理答案)
(写出实验步骤、现象和结论)。(4)步骤③过滤出的沉淀物是
$\mathrm{Mg(OH)}_2($或氢氧化镁)
。(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定的氢氧化钠的质量分数将
偏大
(填“偏大”“偏小”或“没影响”)。答案:11.探究一:取样,滴加几滴无色酚酞溶液(或其他合理答案) 溶液变红色(或其他合理答案) 探究二:$(1)\mathrm{NaOH} + \mathrm{HCl} \longrightarrow \mathrm{NaCl} + \mathrm{H}_2\mathrm{O} (2)9.8 (3)$使$\mathrm{NaOH}$完全反应 往上层澄清液体中继续滴加氯化镁溶液,若无白色沉淀生成,说明所加氯化镁溶液已足量(或其他合理答案)
$(4)\mathrm{Mg(OH)}_2($或氢氧化镁) (5)偏大
$(4)\mathrm{Mg(OH)}_2($或氢氧化镁) (5)偏大