20. (12分)盐酸是一种重要的化工原料,也是实验室中常用的化学试剂。
Ⅰ. 盐酸的性质
为验证盐酸的部分化学性质,某小组使用四种不同类别的物质——NaOH、CaCO₃、Mg和物质X进行相关实验。
(1)实验时观察到稀盐酸与X反应有黄色溶液生成,则物质X是
(2)将稀盐酸滴入NaOH溶液时无明显现象,为证明二者发生了反应,该小组同学在实验前向氢氧化钠溶液中滴加了几滴酚酞溶液,实验中观察到
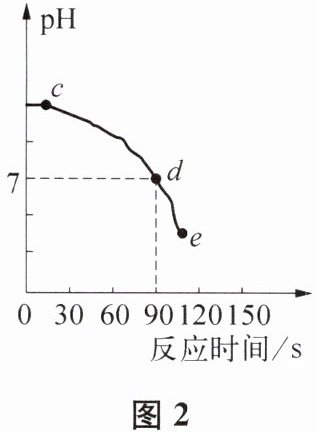
(3)该小组利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,用pH传感器测得pH随反应时间的变化情况如图2所示。
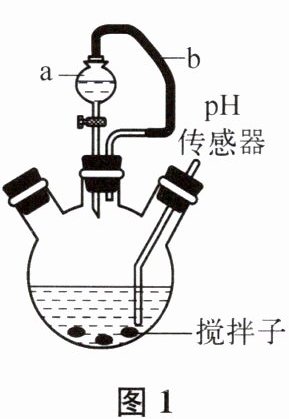
①图1中橡皮管b的作用是
②图2中e点所示溶液中的溶质是
③图2中d→e所示溶液中NaCl的质量
Ⅱ. 盐酸的利用
查阅资料:①Fe、FeₓCᵧ在加热时与O₂反应能生成相应氧化物;②FeₓCᵧ不与酸反应;③碱石灰是由氢氧化钠和氧化钙组成的混合物。
以黄铁矿为原料得到铁的氧化物,再与碳反应生成还原铁粉,其中除了含有铁粉,还含有少量FeₓCᵧ和少量杂质(杂质不与酸反应且不与氧气反应),小组同学利用稀盐酸测定还原铁粉中FeₓCᵧ的组成。
实验1:取30g还原铁粉样品,加入足量稀盐酸,充分反应后生成0.8g H₂。
实验2:另取30g还原铁粉样品,按图3进行实验。通入氧气充分反应后,A中固体变为红棕色,继续通入氧气一段时间,冷却后称得装置B增重0.44g。把A玻璃管中反应后的固体加入足量稀盐酸,充分反应后,过滤,将滤渣干燥后称得质量为5.8g。
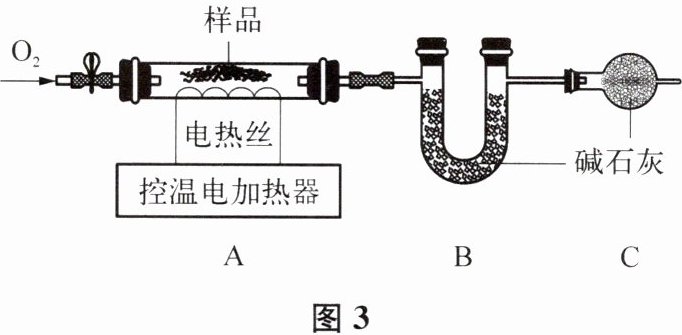
(4)实验1中产生H₂的化学方程式为
(5)装置C中碱石灰的作用是
(6)还原铁粉中FeₓCᵧ的x∶y=
Ⅰ. 盐酸的性质
为验证盐酸的部分化学性质,某小组使用四种不同类别的物质——NaOH、CaCO₃、Mg和物质X进行相关实验。
(1)实验时观察到稀盐酸与X反应有黄色溶液生成,则物质X是
$\mathrm{Fe}_2\mathrm{O}_3$
(填化学式)。(2)将稀盐酸滴入NaOH溶液时无明显现象,为证明二者发生了反应,该小组同学在实验前向氢氧化钠溶液中滴加了几滴酚酞溶液,实验中观察到
溶液由红色变成无色
现象时说明二者发生了反应。(3)该小组利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,用pH传感器测得pH随反应时间的变化情况如图2所示。


①图1中橡皮管b的作用是
缓冲气压,便于液体滴下
。②图2中e点所示溶液中的溶质是
$\mathrm{NaCl}$、$\mathrm{HCl}$
(填化学式)。③图2中d→e所示溶液中NaCl的质量
不变
(填“增大”“减小”或“不变”)。Ⅱ. 盐酸的利用
查阅资料:①Fe、FeₓCᵧ在加热时与O₂反应能生成相应氧化物;②FeₓCᵧ不与酸反应;③碱石灰是由氢氧化钠和氧化钙组成的混合物。
以黄铁矿为原料得到铁的氧化物,再与碳反应生成还原铁粉,其中除了含有铁粉,还含有少量FeₓCᵧ和少量杂质(杂质不与酸反应且不与氧气反应),小组同学利用稀盐酸测定还原铁粉中FeₓCᵧ的组成。
实验1:取30g还原铁粉样品,加入足量稀盐酸,充分反应后生成0.8g H₂。
实验2:另取30g还原铁粉样品,按图3进行实验。通入氧气充分反应后,A中固体变为红棕色,继续通入氧气一段时间,冷却后称得装置B增重0.44g。把A玻璃管中反应后的固体加入足量稀盐酸,充分反应后,过滤,将滤渣干燥后称得质量为5.8g。

(4)实验1中产生H₂的化学方程式为
$\mathrm{Fe}+2\mathrm{HCl}=\mathrm{FeCl}_2+\mathrm{H}_2\uparrow$
。(5)装置C中碱石灰的作用是
防止空气中的二氧化碳和水蒸气进入B中,干扰二氧化碳的测定
。(6)还原铁粉中FeₓCᵧ的x∶y=
3∶1
。答案:20.(1)$\mathrm{Fe}_2\mathrm{O}_3$ (2)溶液由红色变成无色 (3)①缓冲气压,便于液体滴下 ②$\mathrm{NaCl}$、$\mathrm{HCl}$ ③不变 (4)$\mathrm{Fe}+2\mathrm{HCl}=\mathrm{FeCl}_2+\mathrm{H}_2\uparrow$ (5)防止空气中的二氧化碳和水蒸气进入B中,干扰二氧化碳的测定 (6)3∶1