19. (17分)我国化工专家侯德榜创立了“侯氏联合制碱法”,为纯碱(Na₂CO₃)制造作出了重大贡献,促进了世界制碱技术的发展。化学小组对制碱过程进行项目化学习。
任务1:认识原理
NaCl + NH₃ + CO₂ + H₂O $\xlongequal{}$ NaHCO₃↓ + NH₄Cl;
2NaHCO₃ $\xlongequal{\triangle}$ Na₂CO₃ + CO₂↑ + H₂O。
任务2:制备原料
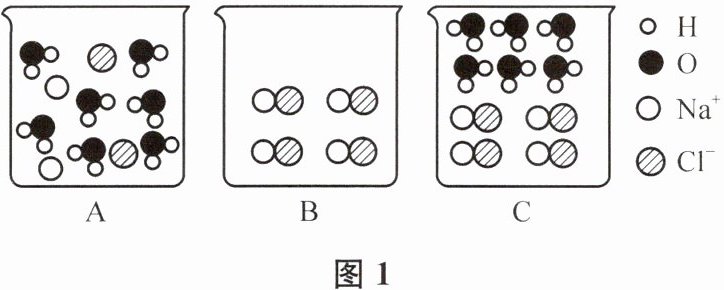
(1)配制饱和氯化钠溶液。常温下,NaCl的溶解度为36g。该温度下,将
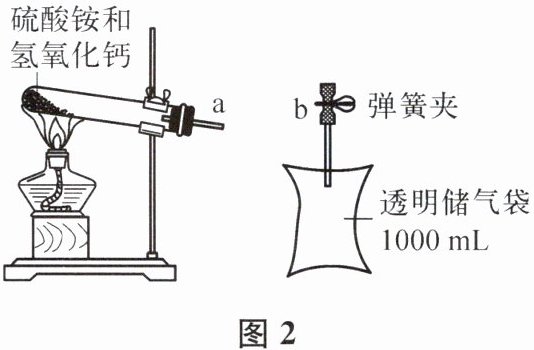
(2)获取气体。加热硫酸铵和氢氧化钙的固体混合物,将湿润的红色石蕊试纸放在导管a端,当观察到
任务3:探秘变化
用注射器抽取约5mL饱和食盐水,将其从导管b端注入盛有NH₃的储气袋中,关闭弹簧夹,振荡至储气袋完全变瘪。再将该袋内全部液体用注射器吸出,注入盛有CO₂的储气袋中,关闭弹簧夹充分振荡,静置后观察到袋内有白色固体析出。请结合图3溶解度曲线回答下列问题。
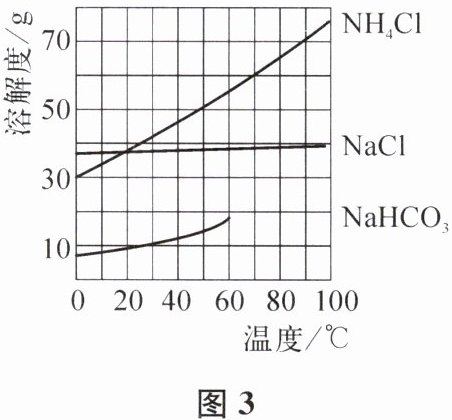
(3)析出的白色固体为NaHCO₃的主要原因是
(4)NaHCO₃的溶解度在60℃后无数据,原因可能是
任务4:应用产品
(5)析出得到的NaHCO₃固体加热分解后即制得产品——纯碱。工业上可用纯碱和熟石灰反应制取氢氧化钠,反应的化学方程式为
(6)副产品NH₄Cl在农业上可用作
任务1:认识原理
NaCl + NH₃ + CO₂ + H₂O $\xlongequal{}$ NaHCO₃↓ + NH₄Cl;
2NaHCO₃ $\xlongequal{\triangle}$ Na₂CO₃ + CO₂↑ + H₂O。
任务2:制备原料
(1)配制饱和氯化钠溶液。常温下,NaCl的溶解度为36g。该温度下,将
18
g NaCl固体完全溶解于50g水配得饱和溶液,此溶液的溶质质量分数为26.5%
(结果精确到0.1%)。从微观角度分析,图1中最接近NaCl溶液真实情况的是A
(填字母)。
(2)获取气体。加热硫酸铵和氢氧化钙的固体混合物,将湿润的红色石蕊试纸放在导管a端,当观察到
湿润的红色石蕊试纸变蓝色
时,连接ab,收集NH₃,待储气袋集满后关闭弹簧夹,如图2所示。再用相同规格的储气袋集满一袋CO₂气体。
任务3:探秘变化
用注射器抽取约5mL饱和食盐水,将其从导管b端注入盛有NH₃的储气袋中,关闭弹簧夹,振荡至储气袋完全变瘪。再将该袋内全部液体用注射器吸出,注入盛有CO₂的储气袋中,关闭弹簧夹充分振荡,静置后观察到袋内有白色固体析出。请结合图3溶解度曲线回答下列问题。

(3)析出的白色固体为NaHCO₃的主要原因是
相同温度下,$\mathrm{NaHCO}_3$的溶解度小于$\mathrm{NH}_4\mathrm{Cl}$的溶解度
。袋内溶液中是否含有NaHCO₃?请设计实验方案证明:取少量袋内溶液于试管中,滴加适量的稀盐酸,若有气泡冒出,说明袋内溶液中含有$\mathrm{NaHCO}_3$
(不可使用酸碱指示剂,写出操作、现象和结论)。(4)NaHCO₃的溶解度在60℃后无数据,原因可能是
60℃时溶液中的$\mathrm{NaHCO}_3$受热分解
。任务4:应用产品
(5)析出得到的NaHCO₃固体加热分解后即制得产品——纯碱。工业上可用纯碱和熟石灰反应制取氢氧化钠,反应的化学方程式为
$\mathrm{Na}_2\mathrm{CO}_3+\mathrm{Ca(OH)}_2= \mathrm{CaCO}_3\downarrow+2\mathrm{NaOH}$
。(6)副产品NH₄Cl在农业上可用作
氮肥
。某工厂用65t NaCl(利用率在90%以上)生产纯碱,同时得到NH₄Cl的质量至少是多少吨?(写出计算过程)答案:19.(1)18 26.5% A (2)湿润的红色石蕊试纸变蓝色 (3)相同温度下,$\mathrm{NaHCO}_3$的溶解度小于$\mathrm{NH}_4\mathrm{Cl}$的溶解度 取少量袋内溶液于试管中,滴加适量的稀盐酸,若有气泡冒出,说明袋内溶液中含有$\mathrm{NaHCO}_3$ (4)60℃时溶液中的$\mathrm{NaHCO}_3$受热分解 (5)$\mathrm{Na}_2\mathrm{CO}_3+\mathrm{Ca(OH)}_2= \mathrm{CaCO}_3\downarrow+2\mathrm{NaOH}$ (6)氮肥 53.5t
解析:
(1)18;26.5%;A
(2)湿润的红色石蕊试纸变蓝色
(3)相同温度下,$\mathrm{NaHCO}_3$的溶解度小于$\mathrm{NH}_4\mathrm{Cl}$的溶解度;取少量袋内溶液于试管中,滴加适量的稀盐酸,若有气泡冒出,说明袋内溶液中含有$\mathrm{NaHCO}_3$
(4)60℃时溶液中的$\mathrm{NaHCO}_3$受热分解
(5)$\mathrm{Na}_2\mathrm{CO}_3+\mathrm{Ca(OH)}_2=\mathrm{CaCO}_3\downarrow+2\mathrm{NaOH}$
(6)氮肥
设得到$\mathrm{NH}_4\mathrm{Cl}$的质量为$x$
$\begin{array}{ll}\mathrm{NaCl}+\mathrm{NH}_3+\mathrm{CO}_2+\mathrm{H}_2\mathrm{O}=&\mathrm{NaHCO}_3\downarrow+\mathrm{NH}_4\mathrm{Cl}\\58.5&53.5\\65\mathrm{t}×90\%&x\end{array}$
$\frac{58.5}{53.5}=\frac{65\mathrm{t}×90\%}{x}$
$x=53.5\mathrm{t}$
答:得到$\mathrm{NH}_4\mathrm{Cl}$的质量至少是$53.5\mathrm{t}$
(2)湿润的红色石蕊试纸变蓝色
(3)相同温度下,$\mathrm{NaHCO}_3$的溶解度小于$\mathrm{NH}_4\mathrm{Cl}$的溶解度;取少量袋内溶液于试管中,滴加适量的稀盐酸,若有气泡冒出,说明袋内溶液中含有$\mathrm{NaHCO}_3$
(4)60℃时溶液中的$\mathrm{NaHCO}_3$受热分解
(5)$\mathrm{Na}_2\mathrm{CO}_3+\mathrm{Ca(OH)}_2=\mathrm{CaCO}_3\downarrow+2\mathrm{NaOH}$
(6)氮肥
设得到$\mathrm{NH}_4\mathrm{Cl}$的质量为$x$
$\begin{array}{ll}\mathrm{NaCl}+\mathrm{NH}_3+\mathrm{CO}_2+\mathrm{H}_2\mathrm{O}=&\mathrm{NaHCO}_3\downarrow+\mathrm{NH}_4\mathrm{Cl}\\58.5&53.5\\65\mathrm{t}×90\%&x\end{array}$
$\frac{58.5}{53.5}=\frac{65\mathrm{t}×90\%}{x}$
$x=53.5\mathrm{t}$
答:得到$\mathrm{NH}_4\mathrm{Cl}$的质量至少是$53.5\mathrm{t}$