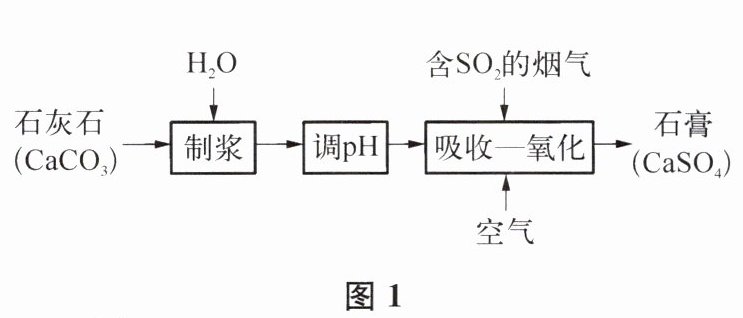
23. (8 分)燃煤烟气中含二氧化硫,石灰石湿法脱硫制备石膏 $\left(\mathrm{CaSO}_{4}\right)$ 的主要流程如图 1 所示。
已知:
a. 当压强不变时,随着温度升高,气体的溶解度减少;
b. 脱硫过程中,其他条件相同时,随浆液酸性增强, $\mathrm{CaCO}_{3}$ 溶解的质量增加, $\mathrm{SO}_{2}$ 吸收的质量减小;
c. $\mathrm{CaSO}_{3}$ 能与稀盐酸反应: $\mathrm{CaSO}_{3}+2 \mathrm{HCl}=\mathrm{CaCl}_{2}+\mathrm{SO}_{2} \uparrow+\mathrm{H}_{2} \mathrm{O}$ 。
(1)大气中二氧化硫含量过高会导致的环境问题是
(2)“制浆”时,石灰石粉碎后加水所得浆液属于
A. 溶液
B. 悬浊液
C. 乳浊液
(3)“吸收一氧化”过程包括: (1) $\mathrm{CaCO}_{3}$ 吸收 $\mathrm{SO}_{2}$ 反应生成 $\mathrm{CaSO}_{3}$; (2) $\mathrm{CaSO}_{3}$ 转化为 $\mathrm{CaSO}_{4}$ 。该过程中反应产物无污染,其总反应的化学方程式为
(4)“吸收一氧化”的脱硫率 $\left(\frac{\mathrm{ 被吸收氧化的 } \mathrm{SO}_{2} \mathrm{ 质量 }}{\mathrm{ 通人烟气中的 } \mathrm{SO}_{2} \mathrm{ 质量 }} × 100 \%\right)$ 受多种因素影响。
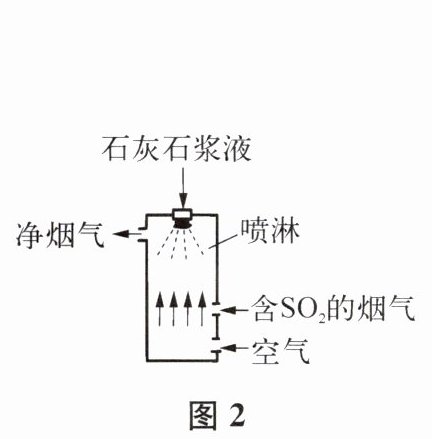
① 吸收塔内采用气液逆流接触吸收的方式(如图 2 所示)。含 $\mathrm{SO}_{2}$ 的烟气从吸收塔底部鼓人,浆液从吸收塔顶部喷淋,其目的是
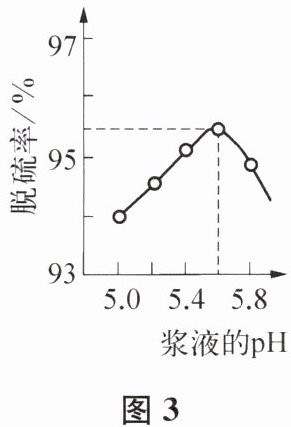
② 其他条件相同,脱硫率受浆液的 $\mathrm{pH}$ 的影响如图 3 所示。浆液的 $\mathrm{pH}$ 高于 5.6 时,脱硫率随 $\mathrm{pH}$ 升高而下降,其原因是
(5)所得石膏产品中混有 $\mathrm{CaSO}_{3}$ 。请补充完整检验 $\mathrm{CaSO}_{3}$ 的实验方案: 取少量所得产品,



已知:
a. 当压强不变时,随着温度升高,气体的溶解度减少;
b. 脱硫过程中,其他条件相同时,随浆液酸性增强, $\mathrm{CaCO}_{3}$ 溶解的质量增加, $\mathrm{SO}_{2}$ 吸收的质量减小;
c. $\mathrm{CaSO}_{3}$ 能与稀盐酸反应: $\mathrm{CaSO}_{3}+2 \mathrm{HCl}=\mathrm{CaCl}_{2}+\mathrm{SO}_{2} \uparrow+\mathrm{H}_{2} \mathrm{O}$ 。
(1)大气中二氧化硫含量过高会导致的环境问题是
酸雨
。(2)“制浆”时,石灰石粉碎后加水所得浆液属于
B
(填字母)。A. 溶液
B. 悬浊液
C. 乳浊液
(3)“吸收一氧化”过程包括: (1) $\mathrm{CaCO}_{3}$ 吸收 $\mathrm{SO}_{2}$ 反应生成 $\mathrm{CaSO}_{3}$; (2) $\mathrm{CaSO}_{3}$ 转化为 $\mathrm{CaSO}_{4}$ 。该过程中反应产物无污染,其总反应的化学方程式为
2CaCO₃+2SO₂+O₂=2CaSO₄+2CO₂
。(4)“吸收一氧化”的脱硫率 $\left(\frac{\mathrm{ 被吸收氧化的 } \mathrm{SO}_{2} \mathrm{ 质量 }}{\mathrm{ 通人烟气中的 } \mathrm{SO}_{2} \mathrm{ 质量 }} × 100 \%\right)$ 受多种因素影响。
① 吸收塔内采用气液逆流接触吸收的方式(如图 2 所示)。含 $\mathrm{SO}_{2}$ 的烟气从吸收塔底部鼓人,浆液从吸收塔顶部喷淋,其目的是
增大SO₂与浆液的接触面积
。鼓人的含 $\mathrm{SO}_{2}$ 的烟气温度过高,会导致脱硫率下降,原因是温度过高,SO₂的溶解度降低
。② 其他条件相同,脱硫率受浆液的 $\mathrm{pH}$ 的影响如图 3 所示。浆液的 $\mathrm{pH}$ 高于 5.6 时,脱硫率随 $\mathrm{pH}$ 升高而下降,其原因是
随pH升高,浆液酸性减弱,CaCO₃溶解的质量减少,导致脱硫率下降;SO₂吸收质量增大,导致脱硫率上升,前者的程度大于后者的程度
。(5)所得石膏产品中混有 $\mathrm{CaSO}_{3}$ 。请补充完整检验 $\mathrm{CaSO}_{3}$ 的实验方案: 取少量所得产品,
加入稀盐酸,将产生的气体通入稀KMnO₄溶液,溶液紫红色褪去(或变浅)
,说明产品中混有 $\mathrm{CaSO}_{3}$ 。(必须使用的试剂: 稀盐酸、稀 $\mathrm{KMnO}_{4}$ 溶液)答案:23.(1)酸雨 (2)B (3)2CaCO₃+2SO₂+O₂=2CaSO₄+2CO₂ (4)①增大SO₂与浆液的接触面积 温度过高,SO₂的溶解度降低 ②随pH升高,浆液酸性减弱,CaCO₃溶解的质量减少,导致脱硫率下降;SO₂吸收质量增大,导致脱硫率上升,前者的程度大于后者的程度 (5)加入稀盐酸,将产生的气体通入稀KMnO₄溶液,溶液紫红色褪去(或变浅)