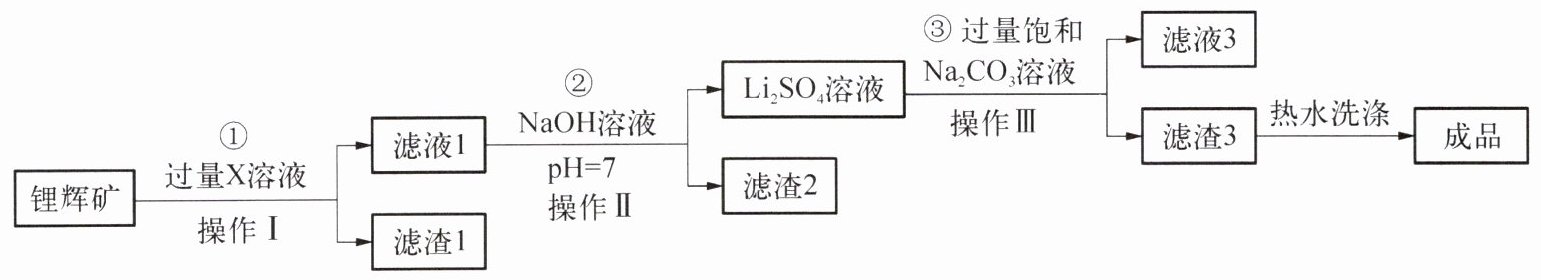
22. (7 分)碳酸锂 $\left(\mathrm{Li}_{2} \mathrm{CO}_{3}\right)$ 是制备新能源汽车电池的重要原料。工业上以锂辉矿为原料制取碳酸锂,其工艺流程如下图所示。
【查阅资料】
Ⅰ. 锂辉矿的主要成分为 $\mathrm{Li}_{2} \mathrm{O} 、 \mathrm{Fe}_{2} \mathrm{O}_{3}$ 和泥沙。
Ⅱ. $\mathrm{Li}_{2} \mathrm{CO}_{3}$ (性质与 $\mathrm{Na}_{2} \mathrm{CO}_{3}$ 类似) 为无色晶体, 微溶于水, 在冷水中的溶解度比热水中大。
(1)X 是一种酸,其溶质化学式为
(2)(2)中加人 $\mathrm{NaOH}$ 溶液调节 $\mathrm{pH}$ 的目的是
(3)(3)中加人 $\mathrm{Na}_{2} \mathrm{CO}_{3}$ 形成滤渣 3 ,反应的化学方程式为
A. $0^{\circ} \mathrm{C}$
B. $25^{\circ} \mathrm{C}$
C. $80^{\circ} \mathrm{C}$

【查阅资料】
Ⅰ. 锂辉矿的主要成分为 $\mathrm{Li}_{2} \mathrm{O} 、 \mathrm{Fe}_{2} \mathrm{O}_{3}$ 和泥沙。
Ⅱ. $\mathrm{Li}_{2} \mathrm{CO}_{3}$ (性质与 $\mathrm{Na}_{2} \mathrm{CO}_{3}$ 类似) 为无色晶体, 微溶于水, 在冷水中的溶解度比热水中大。
(1)X 是一种酸,其溶质化学式为
H₂SO₄
。操作 I 、II 、III 是同一种操作,在此操作中所需用到的玻璃仪器有烧杯、漏斗、玻璃棒
。(2)(2)中加人 $\mathrm{NaOH}$ 溶液调节 $\mathrm{pH}$ 的目的是
除去滤液1中的硫酸铁
。(3)(3)中加人 $\mathrm{Na}_{2} \mathrm{CO}_{3}$ 形成滤渣 3 ,反应的化学方程式为
Li₂SO₄+Na₂CO₃=Li₂CO₃↓+Na₂SO₄
,滤液 3 中溶质有3
种,有以下三种温度的饱和 $\mathrm{Na}_{2} \mathrm{CO}_{3}$ 溶液, (3)中你选择的是C
(填字母)。A. $0^{\circ} \mathrm{C}$
B. $25^{\circ} \mathrm{C}$
C. $80^{\circ} \mathrm{C}$
答案:22.(1)H₂SO₄ 烧杯、漏斗、玻璃棒 (2)除去滤液1中的硫酸铁 (3)Li₂SO₄+Na₂CO₃=Li₂CO₃↓+Na₂SO₄ 3 C
解析:
(1)${H2SO4}$;烧杯、漏斗、玻璃棒
(2)除去滤液1中的硫酸铁
(3)${Li2SO4 + Na2CO3 = Li2CO3↓ + Na2SO4}$;3;C
(2)除去滤液1中的硫酸铁
(3)${Li2SO4 + Na2CO3 = Li2CO3↓ + Na2SO4}$;3;C