6. 下列关于实验现象的描述和解释错误的是(
A.在空气中白磷比红磷更易燃烧,是因为白磷的着火点比红磷低
B.少量浓硫酸倒入蔗糖中搅拌,蔗糖逐渐变黑色,是因为浓硫酸有吸水性
C.打开盛有浓盐酸的瓶盖,瓶口会产生白雾,是因为浓盐酸有挥发性
D.生日宴会时用嘴可吹灭蛋糕上的蜡烛,是因为温度降至蜡烛的着火点以下
B
)A.在空气中白磷比红磷更易燃烧,是因为白磷的着火点比红磷低
B.少量浓硫酸倒入蔗糖中搅拌,蔗糖逐渐变黑色,是因为浓硫酸有吸水性
C.打开盛有浓盐酸的瓶盖,瓶口会产生白雾,是因为浓盐酸有挥发性
D.生日宴会时用嘴可吹灭蛋糕上的蜡烛,是因为温度降至蜡烛的着火点以下
答案:6 B
7.
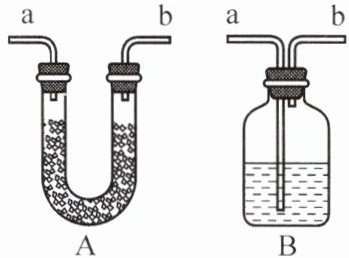
浓硫酸
(填“浓硫酸”或“浓盐酸”)常用作干燥剂,原因是该酸具有吸水
性,该性质属于物理
(填“物理”或“化学”)性质;在进行干燥时,常将该酸置于右图装置B
(填“A”或“B”)中,且气体应从管口a
(填“a”或“b”)通入。
答案:7 浓硫酸 吸水 物理 B a
8. 实验室有三种酸:A. 浓盐酸;B. 稀盐酸;C. 稀硫酸。请回答:
(1)实验室制取二氧化碳时,常用的酸是
(2)制取二氧化碳时不选另外两种酸的原因分别是
(1)实验室制取二氧化碳时,常用的酸是
B
(填字母),常用的固体原料是大理石(或石灰石)
(填物质名称),制取时发生反应的化学方程式为CaCO₃ + 2HCl ══ CaCl₂ + H₂O + CO₂↑
。(2)制取二氧化碳时不选另外两种酸的原因分别是
浓盐酸有强挥发性,使制得的 CO₂ 中混有 HCl 气体而不纯
、大理石与稀硫酸产生的硫酸钙微溶于水,附着在大理石表面阻碍其进一步反应
。答案:8 (1) B 大理石(或石灰石) CaCO₃ + 2HCl ══ CaCl₂ + H₂O + CO₂↑ (2) 浓盐酸有强挥发性,使制得的 CO₂ 中混有 HCl 气体而不纯 大理石与稀硫酸产生的硫酸钙微溶于水,附着在大理石表面阻碍其进一步反应
9. 学完酸、碱、盐的性质后,同学们完成了以下探究硫酸性质的实验活动。
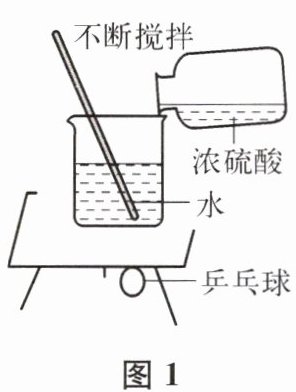
(1)图 1 实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水
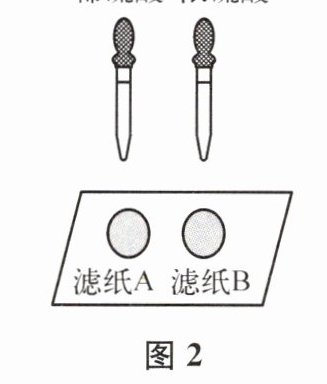
(2)图 2 实验中,观察到很快变黑的是


(1)图 1 实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水
放热
(填“放热”或“吸热”)。若实验室用 98%的浓硫酸(密度为 1.84 g/mL)配制 100 g 溶质质量分数为 20%的稀硫酸,应量取浓硫酸体积多少毫升?水的体积为多少毫升?(计算结果保留一位小数,写出计算过程)。(2)图 2 实验中,观察到很快变黑的是
B
(填“A”或“B”)滤纸。由此可知,硫酸溶液的浓度不同,腐蚀性不同。答案:9 (1) 放热 11.1 mL 79.6 mL (2) B
解析:
(1) 放热
设应量取浓硫酸的体积为$V$,根据稀释前后溶质质量不变:
$1.84\ \mathrm{g/mL} × V × 98\% = 100\ \mathrm{g} × 20\%$
$V = \frac{100\ \mathrm{g} × 20\%}{1.84\ \mathrm{g/mL} × 98\%} \approx 11.1\ \mathrm{mL}$
所需水的质量为$100\ \mathrm{g} - 1.84\ \mathrm{g/mL} × 11.1\ \mathrm{mL} \approx 79.6\ \mathrm{g}$,水的体积为$79.6\ \mathrm{mL}$
(2) B
设应量取浓硫酸的体积为$V$,根据稀释前后溶质质量不变:
$1.84\ \mathrm{g/mL} × V × 98\% = 100\ \mathrm{g} × 20\%$
$V = \frac{100\ \mathrm{g} × 20\%}{1.84\ \mathrm{g/mL} × 98\%} \approx 11.1\ \mathrm{mL}$
所需水的质量为$100\ \mathrm{g} - 1.84\ \mathrm{g/mL} × 11.1\ \mathrm{mL} \approx 79.6\ \mathrm{g}$,水的体积为$79.6\ \mathrm{mL}$
(2) B