6. 把一定量镁粉和铜粉的混合物放入稀硫酸中,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生。下列情况不可能的是(
A.滤渣中只有镁
B.滤渣中只有铜、镁
C.滤液中的溶质含有硫酸镁
D.滤液中的溶质不含硫酸
A
)A.滤渣中只有镁
B.滤渣中只有铜、镁
C.滤液中的溶质含有硫酸镁
D.滤液中的溶质不含硫酸
答案:6.A
解析:
镁粉和铜粉的混合物放入稀硫酸中,镁与稀硫酸反应生成硫酸镁和氢气,铜不与稀硫酸反应。充分反应后过滤,滤渣可能为铜或铜和镁的混合物。向滤渣中加入稀盐酸有气泡产生,说明滤渣中含有镁(镁与稀盐酸反应生成氢气),则滤渣一定含有镁和铜(铜不反应始终在滤渣中),不可能只有镁。滤液中一定含有硫酸镁,可能含有硫酸(若稀硫酸过量)或不含硫酸(若镁粉过量)。
A
A
7. 小明在冬天输液时发现输液管上加了如图1装置,护士告诉他这是一次性输液加热棒,可消除药液温度与体温的差异,小明发现该品牌加热棒里的成分是活性炭粉、氯化钠、还原性铁粉及少量的Fe₃O₄。现对有关物质的性质及成分进行探究。

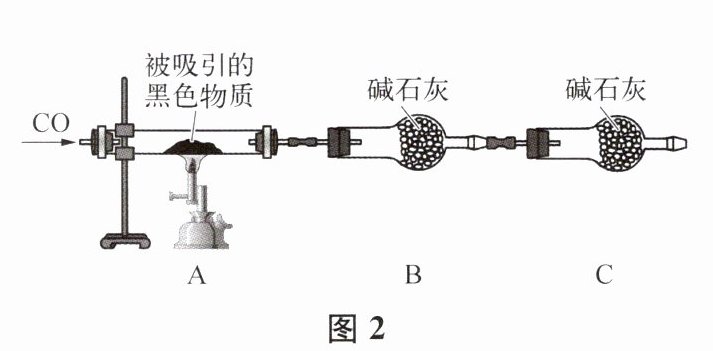
已知:① 铁粉、Fe₃O₄都能被磁铁吸引,均呈黑色,都能与酸溶液反应。
② 碱石灰是氢氧化钠和氧化钙的混合物。
(1)测定铁粉的含量:取一定质量的样品,加入足量稀硫酸,通过测定产生气体的质量计算铁的含量。写出产生气体的化学方程式:
(2)测定活性炭粉的含量:另取10.00g样品,加入足量稀硫酸,经过滤、洗涤、干燥,得到黑色固体0.67g。则活性炭粉的含量为
(3)写出该装置的不足之处:


已知:① 铁粉、Fe₃O₄都能被磁铁吸引,均呈黑色,都能与酸溶液反应。
② 碱石灰是氢氧化钠和氧化钙的混合物。
(1)测定铁粉的含量:取一定质量的样品,加入足量稀硫酸,通过测定产生气体的质量计算铁的含量。写出产生气体的化学方程式:
$\mathrm{Fe + H_2SO_4 \xlongequal{ } FeSO_4 + H_2 \uparrow}$
。(2)测定活性炭粉的含量:另取10.00g样品,加入足量稀硫酸,经过滤、洗涤、干燥,得到黑色固体0.67g。则活性炭粉的含量为
6.7%
。(3)写出该装置的不足之处:
缺少尾气处理装置
。答案:7.(1) $\mathrm{Fe + H_2SO_4 \xlongequal{ } FeSO_4 + H_2 \uparrow}$ (2) 6.7% (3) 缺少尾气处理装置
8. 用含铜废料(含有大量Cu和少量CuS,其他杂质不参与反应)制备Cu(NO₃)₂·3H₂O的一种方法如下:
[已知:Cu + 2HNO₃ + H₂O₂ $\xlongequal{55℃左右}$ Cu(NO₃)₂ + 2H₂O]
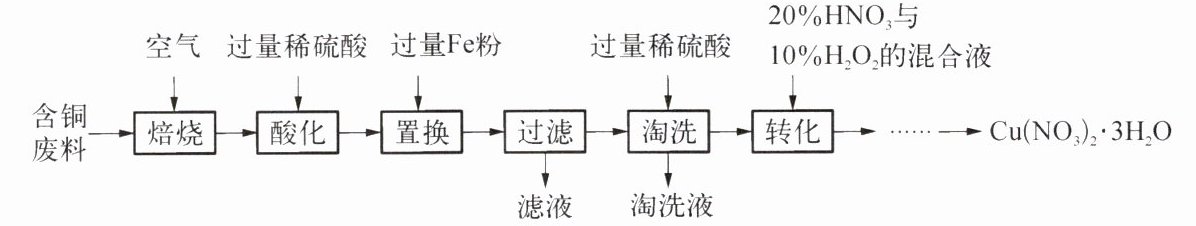
(1)焙烧:在空气中,废料中的少量CuS全部转化为SO₂和一种黑色固体,该黑色固体为
(2)酸化:加入过量稀硫酸后,所得上层清液中的溶质有
(3)置换:加入Fe粉时发生的反应有2个,其化学方程式分别为
(4)淘洗:加入过量稀硫酸是为了除去铜粉中混有的
(5)转化:控制温度在55℃左右,温度不宜过高的原因可能是
[已知:Cu + 2HNO₃ + H₂O₂ $\xlongequal{55℃左右}$ Cu(NO₃)₂ + 2H₂O]

(1)焙烧:在空气中,废料中的少量CuS全部转化为SO₂和一种黑色固体,该黑色固体为
$\mathrm{CuO}$
(填化学式,下同)。(2)酸化:加入过量稀硫酸后,所得上层清液中的溶质有
$\mathrm{CuSO_4、H_2SO_4}$
(填化学式)。(3)置换:加入Fe粉时发生的反应有2个,其化学方程式分别为
$\mathrm{Fe + CuSO_4 \xlongequal{ } Cu + FeSO_4}$
、$\mathrm{Fe + H_2SO_4 \xlongequal{ } FeSO_4 + H_2 \uparrow}$
。(4)淘洗:加入过量稀硫酸是为了除去铜粉中混有的
Fe(或 Fe 粉)
。(5)转化:控制温度在55℃左右,温度不宜过高的原因可能是
温度过高,$\mathrm{H_2O_2}$ 易分解而失效
。答案:8.(1) $\mathrm{CuO}$ (2) $\mathrm{CuSO_4、H_2SO_4}$ (3) $\mathrm{Fe + CuSO_4 \xlongequal{ } Cu + FeSO_4}$ $\mathrm{Fe + H_2SO_4 \xlongequal{ } FeSO_4 + H_2 \uparrow}$ (4) Fe(或 Fe 粉) (5) 温度过高,$\mathrm{H_2O_2}$ 易分解而失效