8. 右图是某同学探究燃烧条件的改装装置,往烧杯中加入下列物质,能让白磷燃烧的是(
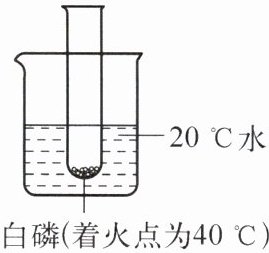
A.硝酸铵
B.氢氧化钠
C.蔗糖
D.食盐
B
)
A.硝酸铵
B.氢氧化钠
C.蔗糖
D.食盐
答案:8. B
解析:
解:燃烧需要同时满足三个条件:可燃物、与氧气(或空气)接触、温度达到可燃物的着火点。白磷是可燃物,且与空气接触,烧杯中为20℃水,白磷着火点为40℃,需加入能使水温升高至40℃及以上的物质。
A.硝酸铵溶于水吸热,水温降低,不能达到着火点,A错误;
B.氢氧化钠溶于水放热,能使水温升高,可达到白磷着火点,B正确;
C.蔗糖溶于水温度无明显变化,水温仍为20℃,不能达到着火点,C错误;
D.食盐溶于水温度无明显变化,水温仍为20℃,不能达到着火点,D错误。
结论:能让白磷燃烧的是B。
B
A.硝酸铵溶于水吸热,水温降低,不能达到着火点,A错误;
B.氢氧化钠溶于水放热,能使水温升高,可达到白磷着火点,B正确;
C.蔗糖溶于水温度无明显变化,水温仍为20℃,不能达到着火点,C错误;
D.食盐溶于水温度无明显变化,水温仍为20℃,不能达到着火点,D错误。
结论:能让白磷燃烧的是B。
B
9. 下图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是(
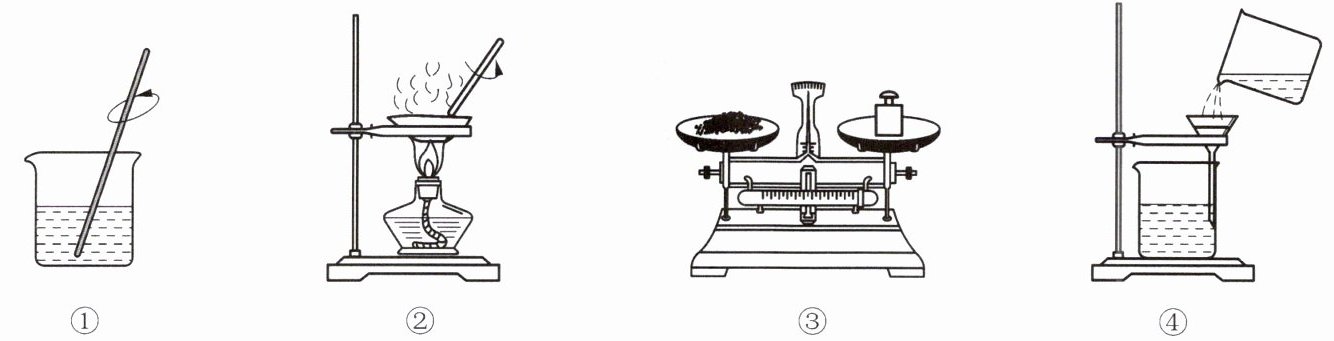
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加快粗盐溶解
C.上述操作的顺序为③①④②
D.当②蒸发皿中液体完全蒸干时停止加热
D
)
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加快粗盐溶解
C.上述操作的顺序为③①④②
D.当②蒸发皿中液体完全蒸干时停止加热
答案:9. D
10. 某化学兴趣小组用如图装置研究二氧化碳的性质。下列有关说法错误的是(
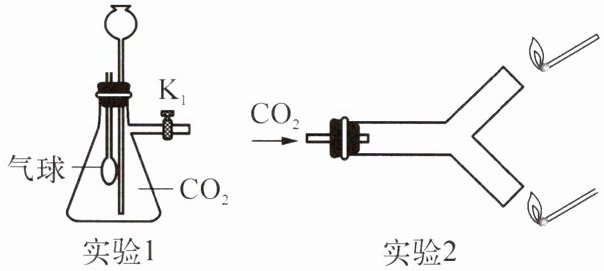
A.实验 1:打开 $K_1$,从长颈漏斗加水没过漏斗下端,关闭 $K_1$,振荡。观察到气球变大
B.实验 1 可以验证 $CO_2$ 与水的反应
C.实验 2 中下端的火柴先熄灭
D.实验 2 可以验证 $CO_2$ 的密度比空气大
B
)
A.实验 1:打开 $K_1$,从长颈漏斗加水没过漏斗下端,关闭 $K_1$,振荡。观察到气球变大
B.实验 1 可以验证 $CO_2$ 与水的反应
C.实验 2 中下端的火柴先熄灭
D.实验 2 可以验证 $CO_2$ 的密度比空气大
答案:10. B
11. 一瓶敞口放置的氢氧化钠溶液,现取少量溶液样品进行实验,能证明氢氧化钠溶液变质的是(
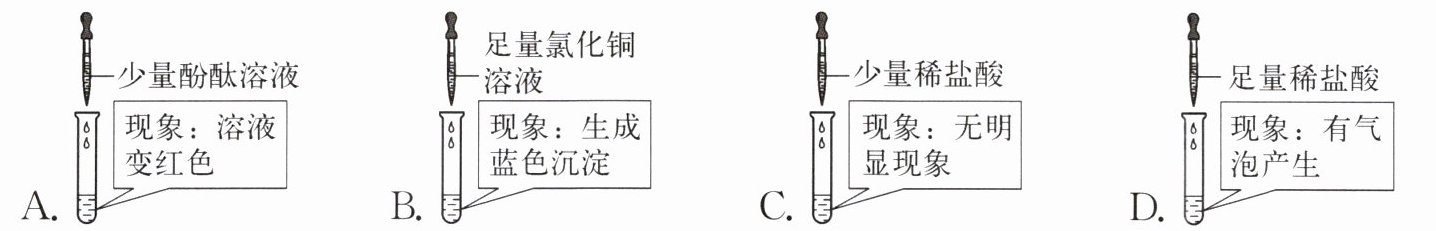
D
)
答案:11. D
解析:
氢氧化钠溶液敞口放置会与空气中的二氧化碳反应生成碳酸钠而变质,变质后的溶液中含有碳酸钠。要证明其变质,需检验溶液中是否含有碳酸钠。
A选项:滴加少量酚酞溶液,氢氧化钠和碳酸钠溶液均显碱性,都会使酚酞变红,无法证明是否变质。
B选项:滴加足量氯化铜溶液,氢氧化钠与氯化铜反应生成氢氧化铜蓝色沉淀,若溶液未变质也会产生相同现象,不能证明变质。
C选项:滴加少量稀盐酸,少量盐酸可能先与未变质的氢氧化钠反应,无明显现象,无法确定是否含有碳酸钠。
D选项:滴加足量稀盐酸,碳酸钠与稀盐酸反应会生成二氧化碳气体,有气泡产生,可证明溶液中含有碳酸钠,即氢氧化钠溶液已变质。
D
A选项:滴加少量酚酞溶液,氢氧化钠和碳酸钠溶液均显碱性,都会使酚酞变红,无法证明是否变质。
B选项:滴加足量氯化铜溶液,氢氧化钠与氯化铜反应生成氢氧化铜蓝色沉淀,若溶液未变质也会产生相同现象,不能证明变质。
C选项:滴加少量稀盐酸,少量盐酸可能先与未变质的氢氧化钠反应,无明显现象,无法确定是否含有碳酸钠。
D选项:滴加足量稀盐酸,碳酸钠与稀盐酸反应会生成二氧化碳气体,有气泡产生,可证明溶液中含有碳酸钠,即氢氧化钠溶液已变质。
D
12. 下列对实验现象的分析合理的是(
A.向某无色溶液中滴入石蕊溶液,呈红色,证明该溶液是酸溶液
B.将某固体物质加到水中,液体温度升高,则该物质一定是氧化钙
C.向某固体中加入稀硫酸,产生无色气体,证明该固体一定是活泼金属
D.某白色固体与熟石灰混合后加热,产生可使湿润的红色石蕊试纸变蓝的气体,证明该固体中含有铵根
D
)A.向某无色溶液中滴入石蕊溶液,呈红色,证明该溶液是酸溶液
B.将某固体物质加到水中,液体温度升高,则该物质一定是氧化钙
C.向某固体中加入稀硫酸,产生无色气体,证明该固体一定是活泼金属
D.某白色固体与熟石灰混合后加热,产生可使湿润的红色石蕊试纸变蓝的气体,证明该固体中含有铵根
答案:12. D
13. 向盛有氯化亚铁和氯化铜混合溶液的烧杯中加入一定量的锌粉,充分反应后,得到固体 M 和溶液 N。下列叙述错误的是(
A.锌有剩余时,M 中一定有 Fe、Cu 和 Zn
B.锌无剩余时,M 中一定有 Cu、可能有 Fe
C.锌有剩余时,N 中一定没有 $FeCl_2$ 和 $CuCl_2$
D.锌无剩余时,N 中一定有 $ZnCl_2$ 和 $FeCl_2$
D
)A.锌有剩余时,M 中一定有 Fe、Cu 和 Zn
B.锌无剩余时,M 中一定有 Cu、可能有 Fe
C.锌有剩余时,N 中一定没有 $FeCl_2$ 和 $CuCl_2$
D.锌无剩余时,N 中一定有 $ZnCl_2$ 和 $FeCl_2$
答案:13. D
解析:
A. 锌有剩余时,锌能与氯化铜、氯化亚铁完全反应,M中一定有Fe、Cu和Zn。
B. 锌无剩余时,锌先与氯化铜反应生成Cu,若锌足量再与氯化亚铁反应生成Fe,M中一定有Cu、可能有Fe。
C. 锌有剩余时,氯化铜、氯化亚铁完全反应,N中一定没有${FeCl2}$和${CuCl2}$。
D. 锌无剩余时,若锌恰好与氯化铜、氯化亚铁完全反应,N中只有${ZnCl2}$,不一定有${FeCl2}$。
答案:D
B. 锌无剩余时,锌先与氯化铜反应生成Cu,若锌足量再与氯化亚铁反应生成Fe,M中一定有Cu、可能有Fe。
C. 锌有剩余时,氯化铜、氯化亚铁完全反应,N中一定没有${FeCl2}$和${CuCl2}$。
D. 锌无剩余时,若锌恰好与氯化铜、氯化亚铁完全反应,N中只有${ZnCl2}$,不一定有${FeCl2}$。
答案:D