7. 可利用下图装置探究水的组成:往A杯中滴加少量的水,水通过灼热的铁管时发生汽化,水蒸气与灼热的铁反应,生成了一种黑色固体(${Fe_{3}O_{4}}$)和“可燃空气”,将气体通过放在冷水中的铜管,在B装置中收集到纯净的可燃空气。最终,拉瓦锡证明了水是由两种元素组成的。
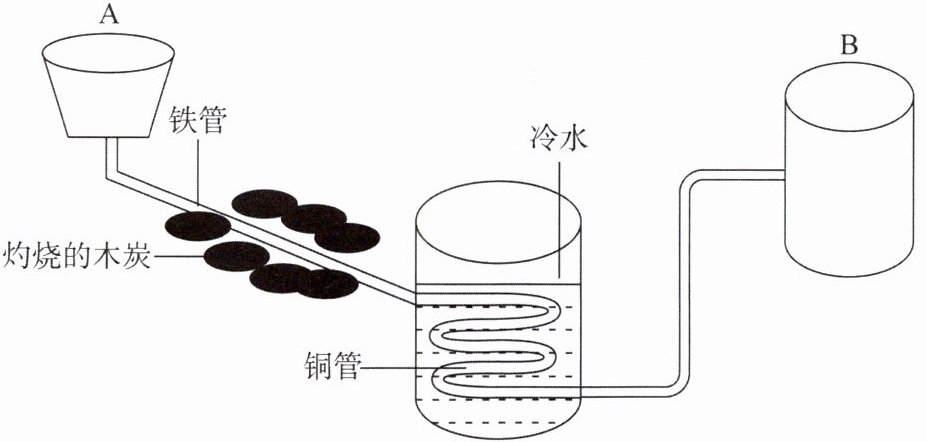
(1)将气体通过放在冷水中的铜管,目的是除去______
(2)将B装置收集到的“可燃空气”在氧气中点燃,生成了水,“可燃空气”的名称是______
(3)若该实验中生成的黑色固体质量为$m_{1}$,“可燃空气”的质量为$m_{2}$,“可燃空气”完全燃烧生成水的质量为$m_{3}$,如果水是由“氧元素”和“可燃空气元素”组成的,则$m_{1}$、$m_{2}$、$m_{3}$三者应满足的关系是______

(1)将气体通过放在冷水中的铜管,目的是除去______
水蒸气
。(2)将B装置收集到的“可燃空气”在氧气中点燃,生成了水,“可燃空气”的名称是______
氢气
。(3)若该实验中生成的黑色固体质量为$m_{1}$,“可燃空气”的质量为$m_{2}$,“可燃空气”完全燃烧生成水的质量为$m_{3}$,如果水是由“氧元素”和“可燃空气元素”组成的,则$m_{1}$、$m_{2}$、$m_{3}$三者应满足的关系是______
$\frac{8}{29}m_1+m_2 = m_3$
。答案:【解析】:
(1)根据题目信息,水蒸气与灼热的铁反应生成了黑色固体(四氧化三铁)和“可燃空气”,将气体通过放在冷水中的铜管,目的是除去水蒸气,从而收集到纯净的可燃空气。
(2)将B装置收集到的“可燃空气”在氧气中点燃,生成了水,根据化学反应前后元素种类不变,可知“可燃空气”是氢气,因为氢气燃烧生成水。
(3)根据质量守恒定律,化学反应前后元素的质量不变。如果水是由“氧元素”和“可燃空气元素(氢元素)”组成的,那么四氧化三铁中的氧元素质量与“可燃空气(氢气)”的质量之和应等于生成水的质量。四氧化三铁中氧元素的质量为$m_1×\frac{16×4}{56×3 + 16×4}$,即$m_1×\frac{64}{232}$,“可燃空气(氢气)”的质量为$m_2$,生成水的质量为$m_3$,所以$m_1×\frac{64}{232}+m_2 = m_3$,化简可得$\frac{8}{29}m_1+m_2 = m_3$
【答案】:
(1)水蒸气
(2)氢气
(3)$\frac{8}{29}m_1+m_2 = m_3$
(1)根据题目信息,水蒸气与灼热的铁反应生成了黑色固体(四氧化三铁)和“可燃空气”,将气体通过放在冷水中的铜管,目的是除去水蒸气,从而收集到纯净的可燃空气。
(2)将B装置收集到的“可燃空气”在氧气中点燃,生成了水,根据化学反应前后元素种类不变,可知“可燃空气”是氢气,因为氢气燃烧生成水。
(3)根据质量守恒定律,化学反应前后元素的质量不变。如果水是由“氧元素”和“可燃空气元素(氢元素)”组成的,那么四氧化三铁中的氧元素质量与“可燃空气(氢气)”的质量之和应等于生成水的质量。四氧化三铁中氧元素的质量为$m_1×\frac{16×4}{56×3 + 16×4}$,即$m_1×\frac{64}{232}$,“可燃空气(氢气)”的质量为$m_2$,生成水的质量为$m_3$,所以$m_1×\frac{64}{232}+m_2 = m_3$,化简可得$\frac{8}{29}m_1+m_2 = m_3$
【答案】:
(1)水蒸气
(2)氢气
(3)$\frac{8}{29}m_1+m_2 = m_3$
8. 实验室用40 g 高锰酸钾分解制氧气,反应一段时间后称得剩余固体的质量为36.8 g,则:(1)生成氧气多少克?(2)消耗了多少克高锰酸钾?(3)剩余固体中含有哪些物质?
答案:解:(1)根据质量守恒定律,生成氧气的质量为40g - 36.8g = 3.2g。
(2)设消耗高锰酸钾的质量为x。
2KMnO₄$\xlongequal{\triangle}$K₂MnO₄ + MnO₂ + O₂↑
316 32
x 3.2g
$\frac{316}{32} = \frac{x}{3.2g}$
x = 31.6g
(3)剩余高锰酸钾的质量为40g - 31.6g = 8.4g,故剩余固体中含有高锰酸钾、锰酸钾和二氧化锰。
(1)3.2g
(2)31.6g
(3)高锰酸钾、锰酸钾、二氧化锰
(2)设消耗高锰酸钾的质量为x。
2KMnO₄$\xlongequal{\triangle}$K₂MnO₄ + MnO₂ + O₂↑
316 32
x 3.2g
$\frac{316}{32} = \frac{x}{3.2g}$
x = 31.6g
(3)剩余高锰酸钾的质量为40g - 31.6g = 8.4g,故剩余固体中含有高锰酸钾、锰酸钾和二氧化锰。
(1)3.2g
(2)31.6g
(3)高锰酸钾、锰酸钾、二氧化锰
9. 实验室需要制取8.8 L二氧化碳用于探究二氧化碳的性质。如果用大理石和稀盐酸反应制取这些气体,需要多少克含碳酸钙80%的大理石?(二氧化碳的密度以$2\ {g\cdot L^{-1}}$计)
答案:【解析】:
本题主要考查了根据化学反应方程式的计算,同时涉及到了密度、体积和质量之间的关系。
首先,我们需要根据给定的二氧化碳的体积和密度,计算出二氧化碳的质量。然后,利用化学方程式计算出参与反应的碳酸钙的质量。最后,由于大理石中碳酸钙的含量为$80\%$,我们需要将计算出的碳酸钙质量除以$80\%$,以得到所需的大理石的质量。
具体计算过程如下:
1. 计算二氧化碳的质量:
根据公式 $m = \rho V$,其中m是质量,$\rho$ 是密度,V是体积,我们可以得到:
$m_{CO_2} = 2\ {g\cdot L^{-1}} × 8.8\ L = 17.6\ g$
2. 利用化学方程式计算碳酸钙的质量:
设需要碳酸钙的质量为x,则根据化学方程式 $CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow$,我们可以得到比例关系:
$\frac{100}{44} = \frac{x}{17.6\ g}$
解这个比例式,我们得到:
$x = 40\ g$
3. 计算所需的大理石的质量:
由于大理石中碳酸钙的含量为$80\%$,所以所需的大理石的质量为:
$m_{大理石} = \frac{40\ g}{80\%} = 50\ g$
【答案】:
解:设需要碳酸钙的质量为x。
二氧化碳的质量为$2\ {g\cdot L^{-1}} × 8.8\ L = 17.6\ g$
$CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow$,
100 44
x 17.6 g
$\frac{100}{44} = \frac{x}{17.6\ g}$
解得$x = 40\ g$
则需要大理石的质量为$\frac{40\ g}{80\%} = 50\ g$
答:需要$50g$含碳酸钙$80\%$的大理石。
本题主要考查了根据化学反应方程式的计算,同时涉及到了密度、体积和质量之间的关系。
首先,我们需要根据给定的二氧化碳的体积和密度,计算出二氧化碳的质量。然后,利用化学方程式计算出参与反应的碳酸钙的质量。最后,由于大理石中碳酸钙的含量为$80\%$,我们需要将计算出的碳酸钙质量除以$80\%$,以得到所需的大理石的质量。
具体计算过程如下:
1. 计算二氧化碳的质量:
根据公式 $m = \rho V$,其中m是质量,$\rho$ 是密度,V是体积,我们可以得到:
$m_{CO_2} = 2\ {g\cdot L^{-1}} × 8.8\ L = 17.6\ g$
2. 利用化学方程式计算碳酸钙的质量:
设需要碳酸钙的质量为x,则根据化学方程式 $CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow$,我们可以得到比例关系:
$\frac{100}{44} = \frac{x}{17.6\ g}$
解这个比例式,我们得到:
$x = 40\ g$
3. 计算所需的大理石的质量:
由于大理石中碳酸钙的含量为$80\%$,所以所需的大理石的质量为:
$m_{大理石} = \frac{40\ g}{80\%} = 50\ g$
【答案】:
解:设需要碳酸钙的质量为x。
二氧化碳的质量为$2\ {g\cdot L^{-1}} × 8.8\ L = 17.6\ g$
$CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow$,
100 44
x 17.6 g
$\frac{100}{44} = \frac{x}{17.6\ g}$
解得$x = 40\ g$
则需要大理石的质量为$\frac{40\ g}{80\%} = 50\ g$
答:需要$50g$含碳酸钙$80\%$的大理石。