5. 下列有关CO和$Fe_2O_3$反应的叙述,不符合实验事实的是(
A.CO还原$Fe_2O_3$时,粉末由黑色变为红棕色
B.CO还原$Fe_2O_3$后,得到的粉末能被磁铁吸引
C.开始通CO时,澄清石灰水不变浑浊,说明还未生成$CO_2$
D.如果停止加热的同时也停止通CO,会看到黑色粉末又变成红棕色
A
)。A.CO还原$Fe_2O_3$时,粉末由黑色变为红棕色
B.CO还原$Fe_2O_3$后,得到的粉末能被磁铁吸引
C.开始通CO时,澄清石灰水不变浑浊,说明还未生成$CO_2$
D.如果停止加热的同时也停止通CO,会看到黑色粉末又变成红棕色
答案:【解析】:
选项A:考察CO还原$Fe_2O_3$的反应现象。$Fe_2O_3$是红棕色固体,被CO还原后会生成黑色的铁粉,而不是由黑色变为红棕色。故A选项错误。
选项B:考察CO还原$Fe_2O_3$后产物的性质。CO还原$Fe_2O_3$后得到的是铁粉,铁粉能被磁铁吸引。故B选项正确。
选项C:考察CO还原$Fe_2O_3$的实验过程。开始通CO时,由于温度可能还未达到反应所需的高温,因此不会立即生成$CO_2$,澄清石灰水不会变浑浊。这符合实验事实。故C选项正确。
选项D:考察CO还原$Fe_2O_3$后冷却过程中的变化。如果停止加热的同时也停止通CO,已经还原生成的铁粉会再次被空气中的氧气氧化,由黑色变回红棕色的$Fe_2O_3$。但在实际实验中,为了防止生成的铁粉再次被氧化,通常会继续通入CO直到装置冷却。故D选项描述的实验现象在特定条件下(即停止通CO)是可能发生的,但不符合常规实验操作,不过从化学原理上看,该叙述本身是正确的,只是实际操作中会避免这种情况。但根据题目要求选择不符合实验事实的选项,D选项描述的现象在理论上是可以发生的,只是不是实验中的常规操作。然而,与A选项的明显错误相比,D选项的表述更偏向于一个理论上的可能性,而在实际实验操作中会避免。因此,根据题目要求选择最不符合实验事实的选项,D选项虽然理论上可能,但不是本题的重点错误。故D选项本身描述无误,不是本题答案。
【答案】:A
选项A:考察CO还原$Fe_2O_3$的反应现象。$Fe_2O_3$是红棕色固体,被CO还原后会生成黑色的铁粉,而不是由黑色变为红棕色。故A选项错误。
选项B:考察CO还原$Fe_2O_3$后产物的性质。CO还原$Fe_2O_3$后得到的是铁粉,铁粉能被磁铁吸引。故B选项正确。
选项C:考察CO还原$Fe_2O_3$的实验过程。开始通CO时,由于温度可能还未达到反应所需的高温,因此不会立即生成$CO_2$,澄清石灰水不会变浑浊。这符合实验事实。故C选项正确。
选项D:考察CO还原$Fe_2O_3$后冷却过程中的变化。如果停止加热的同时也停止通CO,已经还原生成的铁粉会再次被空气中的氧气氧化,由黑色变回红棕色的$Fe_2O_3$。但在实际实验中,为了防止生成的铁粉再次被氧化,通常会继续通入CO直到装置冷却。故D选项描述的实验现象在特定条件下(即停止通CO)是可能发生的,但不符合常规实验操作,不过从化学原理上看,该叙述本身是正确的,只是实际操作中会避免这种情况。但根据题目要求选择不符合实验事实的选项,D选项描述的现象在理论上是可以发生的,只是不是实验中的常规操作。然而,与A选项的明显错误相比,D选项的表述更偏向于一个理论上的可能性,而在实际实验操作中会避免。因此,根据题目要求选择最不符合实验事实的选项,D选项虽然理论上可能,但不是本题的重点错误。故D选项本身描述无误,不是本题答案。
【答案】:A
6. 某同学将铁钉放入硫酸铜溶液时,除看到有紫红色物质析出,还发现有无色无气味气体产生的"异常"现象。推测该气体可能是(
A.氢气
B.二氧化硫
C.二氧化碳
D.一氧化碳
A
)。A.氢气
B.二氧化硫
C.二氧化碳
D.一氧化碳
答案:解:根据质量守恒定律,化学反应前后元素种类不变。铁钉放入硫酸铜溶液中,反应物为铁(Fe)和硫酸铜(CuSO₄),含有的元素为铁、铜、硫、氧、氢(硫酸铜溶液中含水,水含氢、氧元素)。
选项分析:
A. 氢气(H₂):由氢元素组成,反应物中含水,有氢元素,可能产生。
B. 二氧化硫(SO₂):有刺激性气味,题目中气体无色无气味,不符合。
C. 二氧化碳(CO₂):反应物中不含碳元素,不可能产生。
D. 一氧化碳(CO):反应物中不含碳元素,不可能产生。
结论:该气体可能是氢气。
答案:A
选项分析:
A. 氢气(H₂):由氢元素组成,反应物中含水,有氢元素,可能产生。
B. 二氧化硫(SO₂):有刺激性气味,题目中气体无色无气味,不符合。
C. 二氧化碳(CO₂):反应物中不含碳元素,不可能产生。
D. 一氧化碳(CO):反应物中不含碳元素,不可能产生。
结论:该气体可能是氢气。
答案:A
7. 金属材料广泛应用于生产生活中。
(1) 右图台灯中,铜质插头利用了铜的
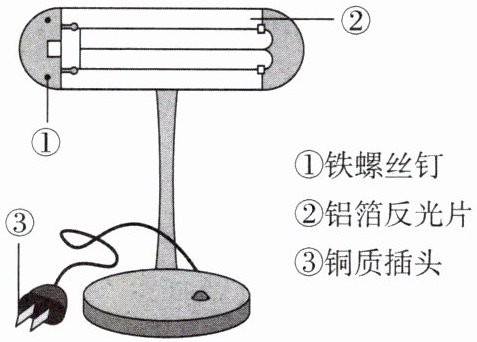
(2) 现代工业炼铁设备通常是
(3) 某锌粉中含有铜、镁中的一种杂质,取该样品6.5 g与足量稀盐酸充分反应,生成氢气0.21 g,该锌粉中含有的杂质是
(4) 当两种活泼性不同的金属在潮湿的环境中接触时,活泼性强的金属首先被腐蚀。利用这一原理,为了保护轮船的钢质外壳,通常在行驶的轮船外壳上连接
(1) 右图台灯中,铜质插头利用了铜的
导电
性。灯管后面的反光片为铝箔。打磨铝箔后放入稀盐酸,可看到铝箔表面产生气泡
,化学方程式为$2Al + 6HCl = 2AlCl_3 + 3H_2\uparrow$
。
(2) 现代工业炼铁设备通常是
高炉
,若原料使用磁铁矿,则主要反应原理用化学方程式表示为$4CO + Fe_3O_4\xlongequal{高温}3Fe + 4CO_2$
。(3) 某锌粉中含有铜、镁中的一种杂质,取该样品6.5 g与足量稀盐酸充分反应,生成氢气0.21 g,该锌粉中含有的杂质是
镁
。(4) 当两种活泼性不同的金属在潮湿的环境中接触时,活泼性强的金属首先被腐蚀。利用这一原理,为了保护轮船的钢质外壳,通常在行驶的轮船外壳上连接
锌块
。答案:【解析】:
(1)台灯中的铜质插头是利用了铜的导电性,因为插头需要传递电流。铝箔在稀盐酸中会发生反应,生成氢气和氯化铝,所以可以看到铝箔表面产生气泡,反应的化学方程式为$2Al + 6HCl = 2AlCl_3 + 3H_2\uparrow$。
(2)现代工业炼铁设备通常是高炉。磁铁矿的主要成分是四氧化三铁,在高炉中,一氧化碳与四氧化三铁反应生成铁和二氧化碳,化学方程式为$4CO + Fe_3O_4\xlongequal{高温}3Fe + 4CO_2$。
(3)假设6.5g全部是锌,根据化学方程式$Zn + 2HCl = ZnCl_2 + H_2\uparrow$,锌的相对原子质量为65,氢气的相对分子质量为2,计算可得生成氢气的质量为0.2g。而实际生成氢气0.21g,说明杂质产生的氢气比等质量的锌多。铜不与稀盐酸反应,镁与稀盐酸反应$Mg + 2HCl = MgCl_2 + H_2\uparrow$,镁的相对原子质量为24,等质量的镁比锌产生的氢气多,所以杂质是镁。
(4)为了保护轮船的钢质外壳,需要连接比铁活泼的金属,锌比铁活泼,铜不如铁活泼,所以应连接锌块。
【答案】:
(1) 导电;表面产生气泡;$2Al + 6HCl = 2AlCl_3 + 3H_2\uparrow$
(2) 高炉;$4CO + Fe_3O_4\xlongequal{高温}3Fe + 4CO_2$
(3) 镁
(4) 锌块
(1)台灯中的铜质插头是利用了铜的导电性,因为插头需要传递电流。铝箔在稀盐酸中会发生反应,生成氢气和氯化铝,所以可以看到铝箔表面产生气泡,反应的化学方程式为$2Al + 6HCl = 2AlCl_3 + 3H_2\uparrow$。
(2)现代工业炼铁设备通常是高炉。磁铁矿的主要成分是四氧化三铁,在高炉中,一氧化碳与四氧化三铁反应生成铁和二氧化碳,化学方程式为$4CO + Fe_3O_4\xlongequal{高温}3Fe + 4CO_2$。
(3)假设6.5g全部是锌,根据化学方程式$Zn + 2HCl = ZnCl_2 + H_2\uparrow$,锌的相对原子质量为65,氢气的相对分子质量为2,计算可得生成氢气的质量为0.2g。而实际生成氢气0.21g,说明杂质产生的氢气比等质量的锌多。铜不与稀盐酸反应,镁与稀盐酸反应$Mg + 2HCl = MgCl_2 + H_2\uparrow$,镁的相对原子质量为24,等质量的镁比锌产生的氢气多,所以杂质是镁。
(4)为了保护轮船的钢质外壳,需要连接比铁活泼的金属,锌比铁活泼,铜不如铁活泼,所以应连接锌块。
【答案】:
(1) 导电;表面产生气泡;$2Al + 6HCl = 2AlCl_3 + 3H_2\uparrow$
(2) 高炉;$4CO + Fe_3O_4\xlongequal{高温}3Fe + 4CO_2$
(3) 镁
(4) 锌块
8. 学习小组同学利用下图实验,回收废弃铜粉与铁粉混合物中的铜粉。

请完成下列分析及计算。
(1) 反应生成氢气的质量是
(2) 计算上述实验回收铜粉的质量。(忽略回收过程中铜粉的损失)
解:设混合物中铁的质量为x。
Fe + H₂SO₄ = FeSO₄ + H₂↑
56 2
x 0.4g
56/2 = x/0.4g,解得x = 11.2g
铜粉质量:30g - 11.2g = 18.8g
答:实验回收铜粉的质量为18.8g。

请完成下列分析及计算。
(1) 反应生成氢气的质量是
0.4
g。(2) 计算上述实验回收铜粉的质量。(忽略回收过程中铜粉的损失)
解:设混合物中铁的质量为x。
Fe + H₂SO₄ = FeSO₄ + H₂↑
56 2
x 0.4g
56/2 = x/0.4g,解得x = 11.2g
铜粉质量:30g - 11.2g = 18.8g
答:实验回收铜粉的质量为18.8g。
答案:【解析】:
(1) 根据反应前后物质的质量差可求出反应生成氢气的质量。反应前物质的总质量为铜粉与铁粉混合物$30g$加上稀硫酸$100g$,即$30g + 100g = 130g$,反应后烧杯内物质总质量为$129.6g$,则生成氢气的质量为$130g - 129.6g = 0.4g$。
(2) 已知铁与稀硫酸反应的化学方程式为$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$,设混合物中铁的质量为$x$。
根据化学方程式可知铁与氢气的质量比为$56:2$,已知生成氢气的质量为$0.4g$,可列出比例式$\frac{56}{2}=\frac{x}{0.4g}$,解得$x = 11.2g$。
因为混合物质量为$30g$,所以铜粉的质量为$30g - 11.2g = 18.8g$。
【答案】:
(1) $0.4$
(2) 解:设混合物中铁的质量为$x$。
$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$
$56$ $2$
$x$ $0.4g$
$\frac{56}{2}=\frac{x}{0.4g}$,解得$x = 11.2g$
铜粉质量:$30g - 11.2g = 18.8g$
答:实验回收铜粉的质量为$18.8g$。
(1) 根据反应前后物质的质量差可求出反应生成氢气的质量。反应前物质的总质量为铜粉与铁粉混合物$30g$加上稀硫酸$100g$,即$30g + 100g = 130g$,反应后烧杯内物质总质量为$129.6g$,则生成氢气的质量为$130g - 129.6g = 0.4g$。
(2) 已知铁与稀硫酸反应的化学方程式为$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$,设混合物中铁的质量为$x$。
根据化学方程式可知铁与氢气的质量比为$56:2$,已知生成氢气的质量为$0.4g$,可列出比例式$\frac{56}{2}=\frac{x}{0.4g}$,解得$x = 11.2g$。
因为混合物质量为$30g$,所以铜粉的质量为$30g - 11.2g = 18.8g$。
【答案】:
(1) $0.4$
(2) 解:设混合物中铁的质量为$x$。
$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$
$56$ $2$
$x$ $0.4g$
$\frac{56}{2}=\frac{x}{0.4g}$,解得$x = 11.2g$
铜粉质量:$30g - 11.2g = 18.8g$
答:实验回收铜粉的质量为$18.8g$。