4. 在化学王国里,数字被赋予了丰富的内涵。下列化学用语中数字“2”的说法正确的是 (
① $2H$ ② $2NH_3$ ③ $SO_2$ ④ $\stackrel{+2}{Cu}O$ ⑤ $Mg^{2+}$ ⑥ $2OH^-$ ⑦ $H_2O$
A.表示离子个数的是⑤⑥
B.表示离子所带电荷数的是④⑤
C.表示分子中原子个数的是③⑦
D.表示分子个数的是①②
C
)① $2H$ ② $2NH_3$ ③ $SO_2$ ④ $\stackrel{+2}{Cu}O$ ⑤ $Mg^{2+}$ ⑥ $2OH^-$ ⑦ $H_2O$
A.表示离子个数的是⑤⑥
B.表示离子所带电荷数的是④⑤
C.表示分子中原子个数的是③⑦
D.表示分子个数的是①②
答案:解:
①$2H$:表示2个氢原子。
②$2NH_3$:表示2个氨分子。
③$SO_2$:表示1个二氧化硫分子中含有2个氧原子。
④$\stackrel{+2}{Cu}O$:表示氧化铜中铜元素的化合价为+2价。
⑤$Mg^{2+}$:表示1个镁离子带2个单位正电荷。
⑥$2OH^-$:表示2个氢氧根离子。
⑦$H_2O$:表示1个水分子中含有2个氢原子。
A.表示离子个数的是⑥,⑤表示离子所带电荷数,A错误。
B.表示离子所带电荷数的是⑤,④表示元素化合价,B错误。
C.表示分子中原子个数的是③⑦,C正确。
D.表示分子个数的是②,①表示原子个数,D错误。
答案:C
①$2H$:表示2个氢原子。
②$2NH_3$:表示2个氨分子。
③$SO_2$:表示1个二氧化硫分子中含有2个氧原子。
④$\stackrel{+2}{Cu}O$:表示氧化铜中铜元素的化合价为+2价。
⑤$Mg^{2+}$:表示1个镁离子带2个单位正电荷。
⑥$2OH^-$:表示2个氢氧根离子。
⑦$H_2O$:表示1个水分子中含有2个氢原子。
A.表示离子个数的是⑥,⑤表示离子所带电荷数,A错误。
B.表示离子所带电荷数的是⑤,④表示元素化合价,B错误。
C.表示分子中原子个数的是③⑦,C正确。
D.表示分子个数的是②,①表示原子个数,D错误。
答案:C
5. 尿素$[CO(NH_2)_2]$、碳酸氢铵$(NH_4HCO_3)$是农业生产中常用的两种氮肥。
(1)请计算:尿素的相对分子质量为
(2)两种氮肥中氮元素的质量分数比较:$CO(NH_2)_2$
(1)请计算:尿素的相对分子质量为
60
;碳酸氢铵的相对分子质量为79
。(2)两种氮肥中氮元素的质量分数比较:$CO(NH_2)_2$
>
$NH_4HCO_3$(填“>”“<”或“=”)。答案:【解析】:
(1)本题考查相对分子质量的计算,相对分子质量是化学式中各个原子的相对原子质量的总和。对于尿素$[CO(NH_2)_2]$,其相对分子质量为$12 + 16 + (14 + 1×2)×2 = 60$;对于碳酸氢铵$(NH_4HCO_3)$,其相对分子质量为$14 + 1×4 + 1 + 12 + 16×3 = 79$。
(2)本题考查元素质量分数的计算,元素质量分数$=\frac{相对原子质量×原子个数}{相对分子质量}×100\%$。尿素中氮元素的质量分数为$\frac{14×2}{60}×100\%\approx46.7\%$;碳酸氢铵中氮元素的质量分数为$\frac{14}{79}×100\%\approx17.7\%$。比较两者大小可得$46.7\%>17.7\%$,所以$CO(NH_2)_2$>$NH_4HCO_3$。
【答案】:
(1)$60$;$79$
(2)>
(1)本题考查相对分子质量的计算,相对分子质量是化学式中各个原子的相对原子质量的总和。对于尿素$[CO(NH_2)_2]$,其相对分子质量为$12 + 16 + (14 + 1×2)×2 = 60$;对于碳酸氢铵$(NH_4HCO_3)$,其相对分子质量为$14 + 1×4 + 1 + 12 + 16×3 = 79$。
(2)本题考查元素质量分数的计算,元素质量分数$=\frac{相对原子质量×原子个数}{相对分子质量}×100\%$。尿素中氮元素的质量分数为$\frac{14×2}{60}×100\%\approx46.7\%$;碳酸氢铵中氮元素的质量分数为$\frac{14}{79}×100\%\approx17.7\%$。比较两者大小可得$46.7\%>17.7\%$,所以$CO(NH_2)_2$>$NH_4HCO_3$。
【答案】:
(1)$60$;$79$
(2)>
1. 我国科学家首次合成的铀-214是目前已知质量最小的铀原子,其相对原子质量为214,质子数是92。铀-214原子的核外电子数为(
A.92
B.122
C.214
D.306
A
)A.92
B.122
C.214
D.306
答案:解:在原子中,核外电子数=质子数。已知铀-214原子的质子数是92,所以其核外电子数为92。
答案:A
答案:A
2. 分子是由原子构成的,原子又由电子、质子与中子等更微小的粒子构成。若以“○”“●”和“◎”分别代表电子、质子与中子,则下列各示意图中带正电的粒子是(
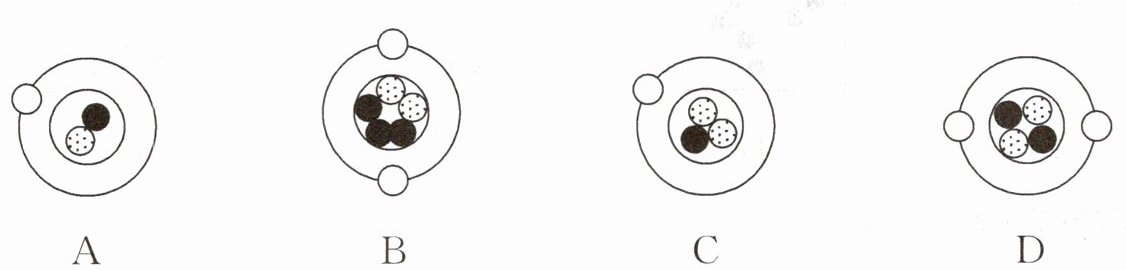
A.
B.
C.
D.
B
)
A.
B.
C.
D.
答案:【解析】:
本题考查原子结构及带电情况,原子由原子核和核外电子构成,原子核由质子和中子构成,质子带正电,中子不带电,电子带负电。带正电的粒子是质子数多于电子数的粒子。
A选项:图中粒子有一个质子(●),一个电子(○),质子数等于电子数,呈电中性,A选项错误。
B选项:图中粒子有六个质子(●),两个电子(○),质子数多于电子数,带正电,B选项正确。
C选项:图中粒子有三个质子(●),四个电子(○),电子数多于质子数,带负电,C选项错误。
D选项:图中粒子有六个质子(●),六个中子(◎),六个电子(○),质子数等于电子数,呈电中性,D选项错误。
【答案】:B
本题考查原子结构及带电情况,原子由原子核和核外电子构成,原子核由质子和中子构成,质子带正电,中子不带电,电子带负电。带正电的粒子是质子数多于电子数的粒子。
A选项:图中粒子有一个质子(●),一个电子(○),质子数等于电子数,呈电中性,A选项错误。
B选项:图中粒子有六个质子(●),两个电子(○),质子数多于电子数,带正电,B选项正确。
C选项:图中粒子有三个质子(●),四个电子(○),电子数多于质子数,带负电,C选项错误。
D选项:图中粒子有六个质子(●),六个中子(◎),六个电子(○),质子数等于电子数,呈电中性,D选项错误。
【答案】:B
3. 下列物质中,氯元素化合价最高的是(
A.KCl
B.$Cl_2$
C.$KClO_3$
D.$ClO_2$
C
)A.KCl
B.$Cl_2$
C.$KClO_3$
D.$ClO_2$
答案:【解析】:
本题考察的是氯元素在不同物质中的化合价判断。
A选项,在$KCl$中,钾元素的化合价为+1,根据化合物中正负化合价代数和为零的原则,可以计算出氯元素的化合价为-1。
B选项,$Cl_{2}$是单质,单质中元素的化合价为零,所以氯元素的化合价为0。
C选项,在$KClO_{3}$中,钾元素的化合价为+1,氧元素的化合价为-2,设氯元素的化合价为x,根据化合物中正负化合价代数和为零的原则,有$(+1) + x + (-2) × 3 = 0$,解得$x = +5$。
D选项,在$ClO_{2}$中,氧元素的化合价为-2,设氯元素的化合价为y,根据化合物中正负化合价代数和为零的原则,有$y + (-2) × 2 = 0$,解得$y = +4$。
比较四个选项中氯元素的化合价,+5是最高价态,所以C选项中氯元素的化合价最高。
【答案】:C
本题考察的是氯元素在不同物质中的化合价判断。
A选项,在$KCl$中,钾元素的化合价为+1,根据化合物中正负化合价代数和为零的原则,可以计算出氯元素的化合价为-1。
B选项,$Cl_{2}$是单质,单质中元素的化合价为零,所以氯元素的化合价为0。
C选项,在$KClO_{3}$中,钾元素的化合价为+1,氧元素的化合价为-2,设氯元素的化合价为x,根据化合物中正负化合价代数和为零的原则,有$(+1) + x + (-2) × 3 = 0$,解得$x = +5$。
D选项,在$ClO_{2}$中,氧元素的化合价为-2,设氯元素的化合价为y,根据化合物中正负化合价代数和为零的原则,有$y + (-2) × 2 = 0$,解得$y = +4$。
比较四个选项中氯元素的化合价,+5是最高价态,所以C选项中氯元素的化合价最高。
【答案】:C
4. “赠人玫瑰,手留余香”,玫瑰中大马酮(化学式为$C_{13}H_{18}O$)是其香味的来源。大马酮中各元素质量分数如图所示。下列有关说法正确的是(

A.大马酮的相对分子质量为190 g
B.大马酮由碳元素、氢元素和氧元素组成
C.大马酮由32个原子构成
D.图中的①代表氢元素的质量分数
B
)
A.大马酮的相对分子质量为190 g
B.大马酮由碳元素、氢元素和氧元素组成
C.大马酮由32个原子构成
D.图中的①代表氢元素的质量分数
答案:【解析】:
A.相对分子质量的单位是“1”而不是“g”,通常省略不写,故A选项错误。
B.根据大马酮的化学式$C_{13}H_{18}O$可知,大马酮由碳元素、氢元素和氧元素组成,故B选项正确。
C.大马酮是由大马酮分子构成的,1个大马酮分子是由13个碳原子、18个氢原子和1个氧原子构成的,共32个原子,而不是大马酮由32个原子构成,故C选项错误。
D.大马酮中碳、氢、氧元素的质量比为$(12×13):(1×18):(16×1)=156:18:16$,可见碳元素的质量分数最大,所以图中的①代表碳元素的质量分数,故D选项错误。
【答案】:B
A.相对分子质量的单位是“1”而不是“g”,通常省略不写,故A选项错误。
B.根据大马酮的化学式$C_{13}H_{18}O$可知,大马酮由碳元素、氢元素和氧元素组成,故B选项正确。
C.大马酮是由大马酮分子构成的,1个大马酮分子是由13个碳原子、18个氢原子和1个氧原子构成的,共32个原子,而不是大马酮由32个原子构成,故C选项错误。
D.大马酮中碳、氢、氧元素的质量比为$(12×13):(1×18):(16×1)=156:18:16$,可见碳元素的质量分数最大,所以图中的①代表碳元素的质量分数,故D选项错误。
【答案】:B