5. 下列是几种粒子的结构示意图,有关说法不正确的是(
① (+2) 2 ② (+12) 2 8 2 ③ (+12) 2 8 ④ (+12) 2 8
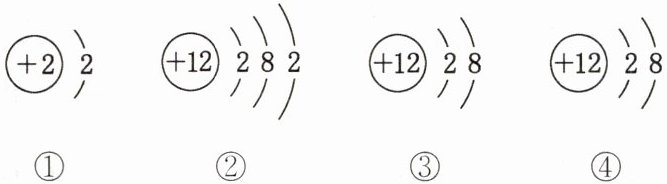
A.①和②两种粒子的化学性质不相似
B.③和④属于离子结构示意图
C.粒子②在化学反应中容易失去电子
D.②③属于同种元素的粒子
B
)① (+2) 2 ② (+12) 2 8 2 ③ (+12) 2 8 ④ (+12) 2 8

A.①和②两种粒子的化学性质不相似
B.③和④属于离子结构示意图
C.粒子②在化学反应中容易失去电子
D.②③属于同种元素的粒子
答案:【解析】:
A选项:①只有一个电子层,该层有2个电子,是稳定结构;而②有三个电子层,最外层有2个电子,易失去电子。所以①和②两种粒子的化学性质不相似,A选项正确。
B选项:③中质子数等于核外电子数,是原子结构示意图;④中质子数大于核外电子数,是离子结构示意图,B选项错误。
C选项:粒子②最外层电子数为2,小于4,在化学反应中容易失去电子,C选项正确。
D选项:②③的质子数都是12,属于同种元素的粒子,D选项正确。
【答案】:B
A选项:①只有一个电子层,该层有2个电子,是稳定结构;而②有三个电子层,最外层有2个电子,易失去电子。所以①和②两种粒子的化学性质不相似,A选项正确。
B选项:③中质子数等于核外电子数,是原子结构示意图;④中质子数大于核外电子数,是离子结构示意图,B选项错误。
C选项:粒子②最外层电子数为2,小于4,在化学反应中容易失去电子,C选项正确。
D选项:②③的质子数都是12,属于同种元素的粒子,D选项正确。
【答案】:B
6. 如图是化学元素周期表中的一部分,下列关于该图的说法正确的是( )

A.X的单质能使带火星的木条复燃
B.核外电子数:X= Y
C.Y和Z同处于第二周期
D.原子序数:Z<Y

A.X的单质能使带火星的木条复燃
B.核外电子数:X= Y
C.Y和Z同处于第二周期
D.原子序数:Z<Y
答案:1. 首先确定$X$、$Y$、$Z$元素:
根据元素周期表的结构,$X$是$O$元素,$Y$是$S$元素,$Z$是$Cl$元素。
2. 然后分析选项:
选项A:
$X$的单质$O_{2}$能使带火星的木条复燃,因为$O_{2}$具有助燃性,$2H_{2}O_{2}\xlongequal{MnO_{2}}2H_{2}O + O_{2}\uparrow$,实验室常用带火星的木条检验$O_{2}$,该选项**正确**。
选项B:
$X$($O$)的核外电子数$=8$,$Y$($S$)的核外电子数$ = 16$,核外电子数$X\neq Y$,该选项**错误**。
选项C:
周期数$=$电子层数,$Y$($S$)和$Z$($Cl$)原子核外都有$3$个电子层,同处于第三周期,该选项**错误**。
选项D:
原子序数$Z(Cl)=17$,$Y(S)=16$,原子序数$Z\gt Y$,该选项**错误**。
综上,答案是A。
根据元素周期表的结构,$X$是$O$元素,$Y$是$S$元素,$Z$是$Cl$元素。
2. 然后分析选项:
选项A:
$X$的单质$O_{2}$能使带火星的木条复燃,因为$O_{2}$具有助燃性,$2H_{2}O_{2}\xlongequal{MnO_{2}}2H_{2}O + O_{2}\uparrow$,实验室常用带火星的木条检验$O_{2}$,该选项**正确**。
选项B:
$X$($O$)的核外电子数$=8$,$Y$($S$)的核外电子数$ = 16$,核外电子数$X\neq Y$,该选项**错误**。
选项C:
周期数$=$电子层数,$Y$($S$)和$Z$($Cl$)原子核外都有$3$个电子层,同处于第三周期,该选项**错误**。
选项D:
原子序数$Z(Cl)=17$,$Y(S)=16$,原子序数$Z\gt Y$,该选项**错误**。
综上,答案是A。
7. 模型法作为科学思维的一种方法,在科学研究和处理实际问题中具有普遍意义。分别用“○”“●”表示质子数不同的原子,则下列物质的模型中表示化合物的是(

A.
B.
C.
D.
B
)
A.
B.
C.
D.
答案:解:化合物是由不同种元素组成的纯净物,从微观角度看,化合物的分子由不同种原子构成,且物质中只含有一种分子。
A选项:图中分子由同种原子构成,为单质,不符合题意。
B选项:图中分子由不同种原子构成,且只含有一种分子,为化合物,符合题意。
C选项:图中含有两种不同的分子,为混合物,不符合题意。
D选项:图中含有两种不同的分子,为混合物,不符合题意。
结论:B
A选项:图中分子由同种原子构成,为单质,不符合题意。
B选项:图中分子由不同种原子构成,且只含有一种分子,为化合物,符合题意。
C选项:图中含有两种不同的分子,为混合物,不符合题意。
D选项:图中含有两种不同的分子,为混合物,不符合题意。
结论:B
8. 图中A、B、C、D是四种粒子的结构示意图。
A. (+12) 2 8 B. (+12) 2 8 2 C. (+17) 2 8 8 D. (+18) 2 8 x

请回答下列问题:
(1) 图中A、B、C、D属于
(2) A、B、C、D四种粒子中,不具备稳定结构的是
(3) D中x=
(4) A与C形成化合物的化学式是
A. (+12) 2 8 B. (+12) 2 8 2 C. (+17) 2 8 8 D. (+18) 2 8 x

请回答下列问题:
(1) 图中A、B、C、D属于
3
种元素的粒子。(2) A、B、C、D四种粒子中,不具备稳定结构的是
B
(填序号)。(3) D中x=
8
。(4) A与C形成化合物的化学式是
MgCl₂
。答案:【解析】
(1) 元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),A、B、C、D粒子的核内质子数分别为12、12、17、18,共表示3种元素。
(2) 最外层电子数为8(氦为2)的结构属于稳定结构,A、B、C、D中A、C、D的最外层电子数均为8,属于稳定结构;B的最外层电子数是2,在化学反应中易失去电子,不具备稳定结构。
(3) D粒子的质子数为18,是氩元素,属于稀有气体元素,化学性质稳定,最外层电子数应为8,所以x = 8。
(4) A粒子质子数为12,核外电子数为10,质子数>核外电子数,为带2个单位正电荷的镁离子,其离子符号为$Mg^{2+}$;C粒子质子数为17,核外电子数为18,质子数<核外电子数,为带1个单位负电荷的氯离子,其离子符号为$Cl^{-}$;A与C形成化合物为氯化镁,镁元素显+2价,氯元素显-1价,其化学式为$MgCl_{2}$。
【答案】
(1) 3
(2) B
(3) 8
(4) $MgCl_{2}$
(1) 元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),A、B、C、D粒子的核内质子数分别为12、12、17、18,共表示3种元素。
(2) 最外层电子数为8(氦为2)的结构属于稳定结构,A、B、C、D中A、C、D的最外层电子数均为8,属于稳定结构;B的最外层电子数是2,在化学反应中易失去电子,不具备稳定结构。
(3) D粒子的质子数为18,是氩元素,属于稀有气体元素,化学性质稳定,最外层电子数应为8,所以x = 8。
(4) A粒子质子数为12,核外电子数为10,质子数>核外电子数,为带2个单位正电荷的镁离子,其离子符号为$Mg^{2+}$;C粒子质子数为17,核外电子数为18,质子数<核外电子数,为带1个单位负电荷的氯离子,其离子符号为$Cl^{-}$;A与C形成化合物为氯化镁,镁元素显+2价,氯元素显-1价,其化学式为$MgCl_{2}$。
【答案】
(1) 3
(2) B
(3) 8
(4) $MgCl_{2}$