1. 下列化学方程式书写正确的是(
A.${S + O2\xlongequal{点燃}SO2↑}$
B.${2H2O2\xlongequal{通电}2H2 + O2}$
C.${2H2O2\xlongequal{MnO2}2H2O + O2↑}$
D.${4P + 5O2\xlongequal{点燃}P2O5}$
C
)A.${S + O2\xlongequal{点燃}SO2↑}$
B.${2H2O2\xlongequal{通电}2H2 + O2}$
C.${2H2O2\xlongequal{MnO2}2H2O + O2↑}$
D.${4P + 5O2\xlongequal{点燃}P2O5}$
答案:【解析】:
A选项:考察硫燃烧的化学方程式。在这个反应中,硫(S)和氧气($O_2$)反应生成二氧化硫($SO_2$)。然而,在生成物后面错误地标注了气体符号“↑”,在这个反应中,二氧化硫是气体,但由于反应物中也有气体参与,所以不需要在生成物后面标注气体符号。因此,A选项错误。
B选项:考察水分解的化学方程式,但给出的方程式实际上是过氧化氢($H_2O_2$)的分解反应,而不是水($H_2O$)的分解。正确的过氧化氢分解反应应该是$2H_2O_2 \xlongequal{MnO_2} 2H_2O + O_2↑$(在二氧化锰的催化下)。此外,反应条件也写错了,应该是“$MnO_2$”而不是“通电”。因此,B选项错误。
C选项:考察过氧化氢分解的化学方程式。在这个反应中,过氧化氢($H_2O_2$)在二氧化锰($MnO_2$)的催化下分解生成水($H_2O$)和氧气($O_2$)。这个方程式完全正确,符合质量守恒定律和化学反应的实际情况。因此,C选项正确。
D选项:考察磷燃烧的化学方程式。在这个反应中,磷(P)和氧气($O_2$)反应生成五氧化二磷($P_2O_5$)。然而,根据质量守恒定律,反应前后的原子个数必须相等。在这个方程式中,反应前的磷原子个数是4,而反应后的五氧化二磷分子中磷原子的个数是2×2=4,看似相等,但实际上五氧化二磷的化学式应该写为$P_2O_5$表示一个分子,所以反应后应该生成2个$P_2O_5$分子以使得磷原子和氧原子都守恒。即正确的方程式应该是$4P + 5O_2\xlongequal{点燃}2P_2O_5$。因此,D选项错误。
【答案】:
C
A选项:考察硫燃烧的化学方程式。在这个反应中,硫(S)和氧气($O_2$)反应生成二氧化硫($SO_2$)。然而,在生成物后面错误地标注了气体符号“↑”,在这个反应中,二氧化硫是气体,但由于反应物中也有气体参与,所以不需要在生成物后面标注气体符号。因此,A选项错误。
B选项:考察水分解的化学方程式,但给出的方程式实际上是过氧化氢($H_2O_2$)的分解反应,而不是水($H_2O$)的分解。正确的过氧化氢分解反应应该是$2H_2O_2 \xlongequal{MnO_2} 2H_2O + O_2↑$(在二氧化锰的催化下)。此外,反应条件也写错了,应该是“$MnO_2$”而不是“通电”。因此,B选项错误。
C选项:考察过氧化氢分解的化学方程式。在这个反应中,过氧化氢($H_2O_2$)在二氧化锰($MnO_2$)的催化下分解生成水($H_2O$)和氧气($O_2$)。这个方程式完全正确,符合质量守恒定律和化学反应的实际情况。因此,C选项正确。
D选项:考察磷燃烧的化学方程式。在这个反应中,磷(P)和氧气($O_2$)反应生成五氧化二磷($P_2O_5$)。然而,根据质量守恒定律,反应前后的原子个数必须相等。在这个方程式中,反应前的磷原子个数是4,而反应后的五氧化二磷分子中磷原子的个数是2×2=4,看似相等,但实际上五氧化二磷的化学式应该写为$P_2O_5$表示一个分子,所以反应后应该生成2个$P_2O_5$分子以使得磷原子和氧原子都守恒。即正确的方程式应该是$4P + 5O_2\xlongequal{点燃}2P_2O_5$。因此,D选项错误。
【答案】:
C
2. 在化学反应前后:①原子的种类;②原子的数目;③元素的种类;④分子的种类;⑤分子的数目;⑥反应物与生成物的质量总和。其中一定不发生变化的是(
A.①②③④
B.①②③⑥
C.②③④⑤
D.①③④⑥
B
)A.①②③④
B.①②③⑥
C.②③④⑤
D.①③④⑥
答案:【解析】:本题考察的是化学反应前后各物理量的变化情况。根据质量守恒定律,化学反应前后,原子的种类、数目、质量都不变,因此元素的种类也不变,反应物与生成物的质量总和也不变。而分子的种类在化学反应中一定会发生改变,因为化学反应的本质就是旧化学键的断裂和新化学键的形成。至于分子的数目,可能改变也可能不改变,这取决于具体的化学反应。因此,一定不发生变化的是原子的种类、原子的数目、元素的种类以及反应物与生成物的质量总和。
【答案】:B
【答案】:B
3. 铝在氧气中燃烧生成氧化铝,反应中铝、氧气、氧化铝的质量比为(
A.27∶32∶102
B.27∶24∶43
C.4∶3∶2
D.108∶96∶204
D
)A.27∶32∶102
B.27∶24∶43
C.4∶3∶2
D.108∶96∶204
答案:解:铝在氧气中燃烧的化学方程式为:4Al + 3O₂ $\frac{\underline{\;点燃\;}}{\;}$ 2Al₂O₃。
各物质的相对分子质量:Al-27,O₂-32,Al₂O₃-102。
铝的质量:4×27 = 108;氧气的质量:3×32 = 96;氧化铝的质量:2×102 = 204。
铝、氧气、氧化铝的质量比为108∶96∶204。
答案:D
各物质的相对分子质量:Al-27,O₂-32,Al₂O₃-102。
铝的质量:4×27 = 108;氧气的质量:3×32 = 96;氧化铝的质量:2×102 = 204。
铝、氧气、氧化铝的质量比为108∶96∶204。
答案:D
4. 某物质在空气中完全燃烧,生成${CO2}和{H2O}$的质量比为11∶9,该物质可能是(
A.${C2H4}$
B.${CH4}$
C.${CH2O}$
D.${C2H5OH}$
B
)A.${C2H4}$
B.${CH4}$
C.${CH2O}$
D.${C2H5OH}$
答案:【解析】:本题主要考查了质量守恒定律的应用以及化学式的确定。
根据质量守恒定律,化学反应前后元素的种类和质量不变,因此,某物质在空气中完全燃烧生成二氧化碳和水,说明该物质中一定含有碳元素和氢元素,可能含有氧元素。
接下来,我们根据生成的二氧化碳和水的质量比来确定该物质中碳元素和氢元素的质量比。已知二氧化碳和水的质量比为$11:9$,设二氧化碳的质量为$11g$,水的质量为$9g$,则二氧化碳中碳元素的质量为$11g × \frac{12}{44} × 100\% = 3g$,水中氢元素的质量为$9g × \frac{2}{18} × 100\% = 1g$。
因此,该物质中碳元素和氢元素的质量比为$3g:1g = 12:4 = 3:1$,则该物质中碳、氢原子的个数比为$\frac{3}{12}:\frac{1}{1} = 1:4$。
最后,我们根据该物质中碳、氢原子的个数比来判断选项中的物质是否符合条件。
A选项:$C_{2}H_{4}$中碳、氢原子的个数比为$1:2$,不符合条件,故A错误;
B选项:$CH_{4}$中碳、氢原子的个数比为$1:4$,符合条件,故B正确;
C选项:$CH_{2}O$中碳、氢原子的个数比为$1:2$,不符合条件,故C错误;
D选项:$C_{2}H_{5}OH$中碳、氢原子的个数比为$1:3$,不符合条件,故D错误。
【答案】:B
根据质量守恒定律,化学反应前后元素的种类和质量不变,因此,某物质在空气中完全燃烧生成二氧化碳和水,说明该物质中一定含有碳元素和氢元素,可能含有氧元素。
接下来,我们根据生成的二氧化碳和水的质量比来确定该物质中碳元素和氢元素的质量比。已知二氧化碳和水的质量比为$11:9$,设二氧化碳的质量为$11g$,水的质量为$9g$,则二氧化碳中碳元素的质量为$11g × \frac{12}{44} × 100\% = 3g$,水中氢元素的质量为$9g × \frac{2}{18} × 100\% = 1g$。
因此,该物质中碳元素和氢元素的质量比为$3g:1g = 12:4 = 3:1$,则该物质中碳、氢原子的个数比为$\frac{3}{12}:\frac{1}{1} = 1:4$。
最后,我们根据该物质中碳、氢原子的个数比来判断选项中的物质是否符合条件。
A选项:$C_{2}H_{4}$中碳、氢原子的个数比为$1:2$,不符合条件,故A错误;
B选项:$CH_{4}$中碳、氢原子的个数比为$1:4$,符合条件,故B正确;
C选项:$CH_{2}O$中碳、氢原子的个数比为$1:2$,不符合条件,故C错误;
D选项:$C_{2}H_{5}OH$中碳、氢原子的个数比为$1:3$,不符合条件,故D错误。
【答案】:B
5. 纯净物甲是一种绿色能源,相对分子质量为46。在一定条件下,一定质量的甲与8.0 g乙恰好完全反应,生成4.4 g丙、5.4 g丁和2.8 g戊。反应的微观示意图如下,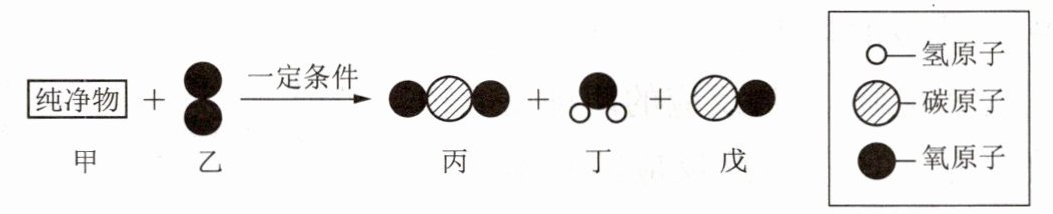 下列有关说法错误的是(
下列有关说法错误的是(
A.参加反应的甲的质量为4.6 g
B.甲物质中碳元素和氢元素的质量比为4∶1
C.甲物质中含有碳、氢、氧三种元素
D.若使生成的戊充分氧化,至少还需乙3.2 g
 下列有关说法错误的是(
下列有关说法错误的是(D
)A.参加反应的甲的质量为4.6 g
B.甲物质中碳元素和氢元素的质量比为4∶1
C.甲物质中含有碳、氢、氧三种元素
D.若使生成的戊充分氧化,至少还需乙3.2 g
答案:【解析】:
本题可根据质量守恒定律来计算参加反应的甲的质量,再通过计算各元素的质量判断甲的元素组成,最后根据化学方程式计算使戊充分氧化所需乙的质量。
选项A:根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。已知生成丙$4.4g$、丁$5.4g$、戊$2.8g$,乙的质量为$8.0g$,则参加反应的甲的质量为$4.4g + 5.4g + 2.8g - 8.0g = 4.6g$,故A选项正确。
选项B:先计算生成物中碳元素和氢元素的质量。
丙是$CO_2$,其中碳元素的质量为$4.4g×\frac{12}{44}×100\% = 1.2g$;
丁是$H_2O$,其中氢元素的质量为$5.4g×\frac{2}{18}×100\% = 0.6g$。
根据质量守恒定律,化学反应前后元素的种类和质量不变,所以甲中碳元素质量为$1.2g$,氢元素质量为$0.6g$,则甲物质中碳元素和氢元素的质量比为$1.2g:0.6g = 4:1$,故B选项正确。
选项C:甲中碳元素质量为$1.2g$,氢元素质量为$0.6g$,碳元素和氢元素的质量和为$1.2g + 0.6g = 1.8g$,而甲的质量为$4.6g$,$4.6g>1.8g$,所以甲中还含有氧元素,即甲物质中含有碳、氢、氧三种元素,故C选项正确。
选项D:由微观示意图可知,甲是乙醇($C_2H_5OH$),乙是氧气($O_2$),丙是二氧化碳($CO_2$),丁是水($H_2O$),戊是一氧化碳($CO$)。
根据上述分析,反应的化学方程式为$C_2H_5OH + 3O_2\xlongequal{一定条件}2CO_2 + 3H_2O + CO$。
一氧化碳与氧气反应的化学方程式为$2CO + O_2\xlongequal{点燃}2CO_2$。
由前面计算可知生成一氧化碳的质量为$2.8g$,设使$2.8g$一氧化碳充分氧化所需氧气的质量为$x$。
$\begin{matrix}&2CO& + &O_2 &\xlongequal{点燃}&2CO_2\\&56&&32\\&2.8g&&x\end{matrix}$
$\frac{56}{32}=\frac{2.8g}{x}$,
解得$x = 1.6g$,即若使生成的戊充分氧化,至少还需乙$1.6g$,而不是$3.2g$,故D选项错误。
【答案】:D
本题可根据质量守恒定律来计算参加反应的甲的质量,再通过计算各元素的质量判断甲的元素组成,最后根据化学方程式计算使戊充分氧化所需乙的质量。
选项A:根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。已知生成丙$4.4g$、丁$5.4g$、戊$2.8g$,乙的质量为$8.0g$,则参加反应的甲的质量为$4.4g + 5.4g + 2.8g - 8.0g = 4.6g$,故A选项正确。
选项B:先计算生成物中碳元素和氢元素的质量。
丙是$CO_2$,其中碳元素的质量为$4.4g×\frac{12}{44}×100\% = 1.2g$;
丁是$H_2O$,其中氢元素的质量为$5.4g×\frac{2}{18}×100\% = 0.6g$。
根据质量守恒定律,化学反应前后元素的种类和质量不变,所以甲中碳元素质量为$1.2g$,氢元素质量为$0.6g$,则甲物质中碳元素和氢元素的质量比为$1.2g:0.6g = 4:1$,故B选项正确。
选项C:甲中碳元素质量为$1.2g$,氢元素质量为$0.6g$,碳元素和氢元素的质量和为$1.2g + 0.6g = 1.8g$,而甲的质量为$4.6g$,$4.6g>1.8g$,所以甲中还含有氧元素,即甲物质中含有碳、氢、氧三种元素,故C选项正确。
选项D:由微观示意图可知,甲是乙醇($C_2H_5OH$),乙是氧气($O_2$),丙是二氧化碳($CO_2$),丁是水($H_2O$),戊是一氧化碳($CO$)。
根据上述分析,反应的化学方程式为$C_2H_5OH + 3O_2\xlongequal{一定条件}2CO_2 + 3H_2O + CO$。
一氧化碳与氧气反应的化学方程式为$2CO + O_2\xlongequal{点燃}2CO_2$。
由前面计算可知生成一氧化碳的质量为$2.8g$,设使$2.8g$一氧化碳充分氧化所需氧气的质量为$x$。
$\begin{matrix}&2CO& + &O_2 &\xlongequal{点燃}&2CO_2\\&56&&32\\&2.8g&&x\end{matrix}$
$\frac{56}{32}=\frac{2.8g}{x}$,
解得$x = 1.6g$,即若使生成的戊充分氧化,至少还需乙$1.6g$,而不是$3.2g$,故D选项错误。
【答案】:D
6. 在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表所示:
|物质|甲|乙|丙|丁|
|反应前的质量/g|20|m|8|6|
|反应后的质量/g|4|待测|28|2|

对该反应,下列描述正确的是(
A.“待测”数值一定为2
B.乙一定是该反应的催化剂
C.反应中甲和丙的质量比为1∶7
D.该反应可能是铜与氧气的反应
|物质|甲|乙|丙|丁|
|反应前的质量/g|20|m|8|6|
|反应后的质量/g|4|待测|28|2|

对该反应,下列描述正确的是(
D
)A.“待测”数值一定为2
B.乙一定是该反应的催化剂
C.反应中甲和丙的质量比为1∶7
D.该反应可能是铜与氧气的反应
答案:【解析】:
我们可以通过反应前后物质的质量变化来判断反应的类型和各选项的正确性。
反应前总质量:$20 + m + 8 + 6 = 34 + m$
反应后总质量:$4 + 待测 + 28 + 2 = 34 + 待测$
根据质量守恒定律,反应前后总质量应相等,因此:
$34 + m = 34 + 待测$
得出:$m = 待测$
分析各选项:
A. “待测”数值一定为2
根据上面的计算,$m = 待测$,但我们并不知道$m$的具体数值,因此无法确定“待测”数值一定为2。故A选项错误。
B. 乙一定是该反应的催化剂
题目中并未给出乙在反应中的具体作用,且乙的质量在反应前后未发生变化,但这并不能直接证明乙是催化剂,因为乙也可能不参与反应。故B选项错误。
C. 反应中甲和丙的质量比为1∶7
反应中甲的质量变化为$20 - 4 = 16g$,丙的质量变化为$28 - 8 = 20g$,因此甲和丙的质量比为$16 : 20 = 4 : 5$,并非$1 : 7$。故C选项错误。
D. 该反应可能是铜与氧气的反应
如果考虑铜与氧气的反应,铜的质量会减少,氧气的质量也会减少(但在此题中未明确给出氧气),而生成的氧化铜的质量会增加。从题目中给出的数据来看,甲的质量减少,丙的质量增加,这符合铜与氧气反应的特点。虽然乙和丁的质量变化不能直接对应氧气和生成的其它物质,但这并不影响我们判断该反应可能是铜与氧气的反应(因为题目中并未明确所有物质)。故D选项正确。
【答案】:D
我们可以通过反应前后物质的质量变化来判断反应的类型和各选项的正确性。
反应前总质量:$20 + m + 8 + 6 = 34 + m$
反应后总质量:$4 + 待测 + 28 + 2 = 34 + 待测$
根据质量守恒定律,反应前后总质量应相等,因此:
$34 + m = 34 + 待测$
得出:$m = 待测$
分析各选项:
A. “待测”数值一定为2
根据上面的计算,$m = 待测$,但我们并不知道$m$的具体数值,因此无法确定“待测”数值一定为2。故A选项错误。
B. 乙一定是该反应的催化剂
题目中并未给出乙在反应中的具体作用,且乙的质量在反应前后未发生变化,但这并不能直接证明乙是催化剂,因为乙也可能不参与反应。故B选项错误。
C. 反应中甲和丙的质量比为1∶7
反应中甲的质量变化为$20 - 4 = 16g$,丙的质量变化为$28 - 8 = 20g$,因此甲和丙的质量比为$16 : 20 = 4 : 5$,并非$1 : 7$。故C选项错误。
D. 该反应可能是铜与氧气的反应
如果考虑铜与氧气的反应,铜的质量会减少,氧气的质量也会减少(但在此题中未明确给出氧气),而生成的氧化铜的质量会增加。从题目中给出的数据来看,甲的质量减少,丙的质量增加,这符合铜与氧气反应的特点。虽然乙和丁的质量变化不能直接对应氧气和生成的其它物质,但这并不影响我们判断该反应可能是铜与氧气的反应(因为题目中并未明确所有物质)。故D选项正确。
【答案】:D