7. 炉甘石的主要成分中含有碱式碳酸锌${[Zn2(OH)2CO3]}$,碱式碳酸锌受热分解不可能生成(
A.${ZnO}$
B.${H2O}$
C.${CO2}$
D.${SO2}$
D
)A.${ZnO}$
B.${H2O}$
C.${CO2}$
D.${SO2}$
答案:【解析】:
本题考察的是碱式碳酸锌受热分解的产物预测,需要依据质量守恒定律来判断。质量守恒定律表明,在化学反应中,反应前后元素的种类和原子的数目都不会改变。因此,我们可以通过观察碱式碳酸锌的化学式${[Zn_2(OH)_2CO_3]}$来确定其分解后可能产生的物质。
在这个化学式中,我们可以看到锌($Zn$)、氧($O$)、氢($H$)和碳($C$)四种元素。根据质量守恒定律,这些元素在分解反应后仍然会存在,且种类不会改变。
A选项中的氧化锌($ZnO$)包含锌和氧两种元素,都存在于碱式碳酸锌中,因此是可能的分解产物。
B选项中的水($H_2O$)包含氢和氧两种元素,也都存在于碱式碳酸锌中,因此同样是可能的分解产物。
C选项中的二氧化碳($CO_2$)包含碳和氧两种元素,也都存在于碱式碳酸锌中,因此也是可能的分解产物。
然而,D选项中的二氧化硫($SO_2$)包含硫和氧两种元素。但我们在碱式碳酸锌的化学式中并没有看到硫元素的存在,因此根据质量守恒定律,二氧化硫不可能是碱式碳酸锌的分解产物。
【答案】:
D
本题考察的是碱式碳酸锌受热分解的产物预测,需要依据质量守恒定律来判断。质量守恒定律表明,在化学反应中,反应前后元素的种类和原子的数目都不会改变。因此,我们可以通过观察碱式碳酸锌的化学式${[Zn_2(OH)_2CO_3]}$来确定其分解后可能产生的物质。
在这个化学式中,我们可以看到锌($Zn$)、氧($O$)、氢($H$)和碳($C$)四种元素。根据质量守恒定律,这些元素在分解反应后仍然会存在,且种类不会改变。
A选项中的氧化锌($ZnO$)包含锌和氧两种元素,都存在于碱式碳酸锌中,因此是可能的分解产物。
B选项中的水($H_2O$)包含氢和氧两种元素,也都存在于碱式碳酸锌中,因此同样是可能的分解产物。
C选项中的二氧化碳($CO_2$)包含碳和氧两种元素,也都存在于碱式碳酸锌中,因此也是可能的分解产物。
然而,D选项中的二氧化硫($SO_2$)包含硫和氧两种元素。但我们在碱式碳酸锌的化学式中并没有看到硫元素的存在,因此根据质量守恒定律,二氧化硫不可能是碱式碳酸锌的分解产物。
【答案】:
D
8. 如图所示,下列实验装置不能用来证明质量守恒定律的是(
C
)答案:【解析】:
A选项:白磷在密闭的锥形瓶中燃烧,反应前后物质都在锥形瓶中,能用来证明质量守恒定律。
B选项:氢氧化钠溶液和硫酸铜溶液在敞口的烧杯中反应,反应没有气体参加和生成,能用来证明质量守恒定律。
C选项:石灰石(碳酸钙)与稀盐酸反应会生成二氧化碳气体,该装置是敞口的,生成的二氧化碳气体会逸散到空气中,导致反应后剩余物质的质量减少,不能用来证明质量守恒定律。
D选项:双氧水在二氧化锰的催化作用下分解生成水和氧气,装置是密闭的,能用来证明质量守恒定律。
【答案】:C
A选项:白磷在密闭的锥形瓶中燃烧,反应前后物质都在锥形瓶中,能用来证明质量守恒定律。
B选项:氢氧化钠溶液和硫酸铜溶液在敞口的烧杯中反应,反应没有气体参加和生成,能用来证明质量守恒定律。
C选项:石灰石(碳酸钙)与稀盐酸反应会生成二氧化碳气体,该装置是敞口的,生成的二氧化碳气体会逸散到空气中,导致反应后剩余物质的质量减少,不能用来证明质量守恒定律。
D选项:双氧水在二氧化锰的催化作用下分解生成水和氧气,装置是密闭的,能用来证明质量守恒定律。
【答案】:C
9. 质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)“酒精检测仪”可检查司机是否酒后驾车,其反应原理为${C2H5OH + 4CrO3 + 6H2SO4 = 2Cr2(SO4)3 + 2CO2↑ + 9X}$,反应中红色的${CrO3}转变为绿色的{Cr2(SO4)3}$,其中X的化学式为
(2)下图为某化学反应的微观模拟图,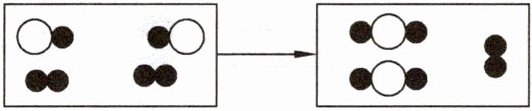 “○”和“●”分别表示两种不同的原子。由“○●”聚集成的物质
“○”和“●”分别表示两种不同的原子。由“○●”聚集成的物质
(3)已知$m_1$g镁条放在空气中完全燃烧,生成$m_2$g氧化镁(不考虑其他反应),$m_1$
小西在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现$m_1>m_2$,其原因是
(1)“酒精检测仪”可检查司机是否酒后驾车,其反应原理为${C2H5OH + 4CrO3 + 6H2SO4 = 2Cr2(SO4)3 + 2CO2↑ + 9X}$,反应中红色的${CrO3}转变为绿色的{Cr2(SO4)3}$,其中X的化学式为
H₂O
。(2)下图为某化学反应的微观模拟图,
 “○”和“●”分别表示两种不同的原子。由“○●”聚集成的物质
“○”和“●”分别表示两种不同的原子。由“○●”聚集成的物质可能
(填“可能”或“不可能”)是氧化物,参加反应的两种反应物的分子个数比为1:2(或2:1)
,此反应的基本反应类型为化合反应
。(3)已知$m_1$g镁条放在空气中完全燃烧,生成$m_2$g氧化镁(不考虑其他反应),$m_1$
<
$m_2$。小西在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现$m_1>m_2$,其原因是
部分生成的氧化镁以白烟的形式逸散到空气中
。答案:【解析】
(1)根据质量守恒定律,化学反应前后原子的种类和数目不变。反应前有2个$C$、18个$H$、4个$Cr$、6个$S$、37个$O$;反应后有2个$C$、0个$H$、4个$Cr$、6个$S$、25个$O$。所以9X中含有18个$H$和12个$O$,则X的化学式为$H_{2}O$。
(2)由微观模拟图可知,“○●”聚集成的物质是由两种原子构成的分子,如果其中一种原子是氧原子,那么该物质就是氧化物,所以可能是氧化物。从图中可以看出,参加反应的两种反应物的分子个数比为$1:2$(或$2:1$)。该反应是由两种物质生成一种物质的反应,属于化合反应。
(3)镁条在空气中燃烧生成氧化镁,根据质量守恒定律,参加反应的镁和氧气的质量总和等于生成的氧化镁的质量,所以$m_{1}\lt m_{2}$。小西实验中$m_{1}\gt m_{2}$,是因为部分生成的氧化镁以白烟的形式逸散到空气中,导致称量的氧化镁质量偏小。
【答案】
(1)$H_{2}O$
(2)可能;$1:2$(或$2:1$);化合反应
(3)$\lt$;部分生成的氧化镁以白烟的形式逸散到空气中
(1)根据质量守恒定律,化学反应前后原子的种类和数目不变。反应前有2个$C$、18个$H$、4个$Cr$、6个$S$、37个$O$;反应后有2个$C$、0个$H$、4个$Cr$、6个$S$、25个$O$。所以9X中含有18个$H$和12个$O$,则X的化学式为$H_{2}O$。
(2)由微观模拟图可知,“○●”聚集成的物质是由两种原子构成的分子,如果其中一种原子是氧原子,那么该物质就是氧化物,所以可能是氧化物。从图中可以看出,参加反应的两种反应物的分子个数比为$1:2$(或$2:1$)。该反应是由两种物质生成一种物质的反应,属于化合反应。
(3)镁条在空气中燃烧生成氧化镁,根据质量守恒定律,参加反应的镁和氧气的质量总和等于生成的氧化镁的质量,所以$m_{1}\lt m_{2}$。小西实验中$m_{1}\gt m_{2}$,是因为部分生成的氧化镁以白烟的形式逸散到空气中,导致称量的氧化镁质量偏小。
【答案】
(1)$H_{2}O$
(2)可能;$1:2$(或$2:1$);化合反应
(3)$\lt$;部分生成的氧化镁以白烟的形式逸散到空气中
10. 物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变呢?甲、乙、丙三位同学按下面的步骤进行探究:
(1)提出假设:物质发生化学变化前后总质量不变。
(2)设计并进行实验,甲设计的实验装置和选用试剂如图A所示(${BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl}$),乙设计的实验装置和选用试剂如图B所示,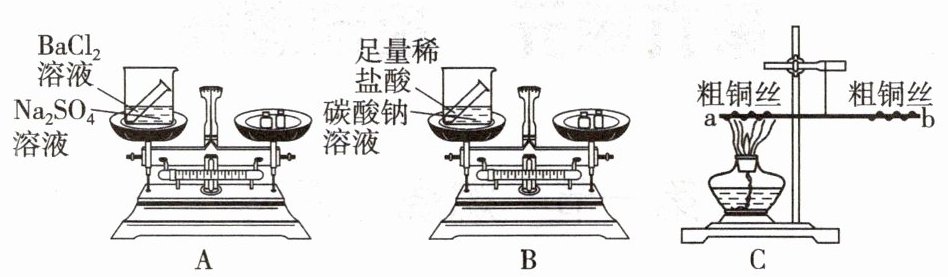 他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
写出B实验发生反应的化学方程式:
(3)实验结论:
甲认为,在化学反应中,生成物的总质量与反应物的总质量相等;
乙、丙认为,在化学反应中,生成物的总质量与反应物的总质量不相等。
(4)你认为
(1)提出假设:物质发生化学变化前后总质量不变。
(2)设计并进行实验,甲设计的实验装置和选用试剂如图A所示(${BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl}$),乙设计的实验装置和选用试剂如图B所示,
 他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
他们在反应前后都进行了规范的操作、准确的称量和细致的观察。写出B实验发生反应的化学方程式:
$Na_{2}CO_{3}+2HCl = 2NaCl + H_{2}O + CO_{2}\uparrow$
。(3)实验结论:
甲认为,在化学反应中,生成物的总质量与反应物的总质量相等;
乙、丙认为,在化学反应中,生成物的总质量与反应物的总质量不相等。
(4)你认为
甲
的结论正确,请从原子的角度分析,结论正确的理由是在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变
。答案:【解析】:
(2)B实验中,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,化学方程式为$Na_{2}CO_{3}+2HCl = 2NaCl + H_{2}O + CO_{2}\uparrow$。
(4)甲的结论正确。从原子角度看,化学反应的过程就是原子重新组合的过程,在化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化,所以化学反应前后各物质的质量总和必然相等。
【答案】:
(2)$Na_{2}CO_{3}+2HCl = 2NaCl + H_{2}O + CO_{2}\uparrow$
(4)甲;在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变
(2)B实验中,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,化学方程式为$Na_{2}CO_{3}+2HCl = 2NaCl + H_{2}O + CO_{2}\uparrow$。
(4)甲的结论正确。从原子角度看,化学反应的过程就是原子重新组合的过程,在化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化,所以化学反应前后各物质的质量总和必然相等。
【答案】:
(2)$Na_{2}CO_{3}+2HCl = 2NaCl + H_{2}O + CO_{2}\uparrow$
(4)甲;在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变