20. (8分)实验课上,同学们利用图1装置进行气体制备的学习。
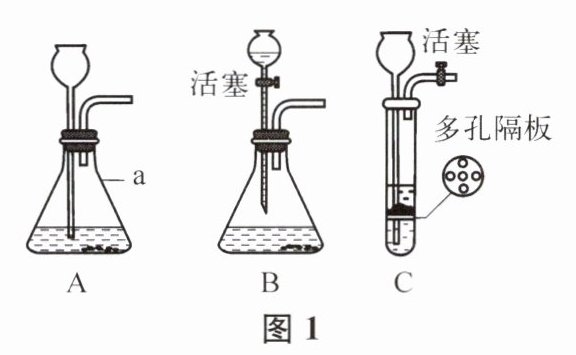
(1)仪器a的名称是
(2)用装置A制取气体时,为防止气体从长颈漏斗口逸出,长颈漏斗下端管口必须处于液面之
(3)取下装置B分液漏斗的玻璃塞,将右边导管封闭,打开分液漏斗的活塞,观察到分液漏斗内的液体不往下滴,
(4)用装置C制取CO₂时,装置C与装置A、B相比较,优点是
(5)制取氢气也可用上述装置,实验室要制取氢气0.2g,至少需要3.65%的稀盐酸(密度为1.02g·mL⁻¹)的体积为多少?(计算结果保留一位小数)


(1)仪器a的名称是
锥形瓶
。(2)用装置A制取气体时,为防止气体从长颈漏斗口逸出,长颈漏斗下端管口必须处于液面之
下
(填“上”或“下”)。(3)取下装置B分液漏斗的玻璃塞,将右边导管封闭,打开分液漏斗的活塞,观察到分液漏斗内的液体不往下滴,
能
(填“能”或“不能”)说明装置B的气密性良好。(4)用装置C制取CO₂时,装置C与装置A、B相比较,优点是
可以控制反应的发生与停止
;使反应停止的操作是关闭活塞
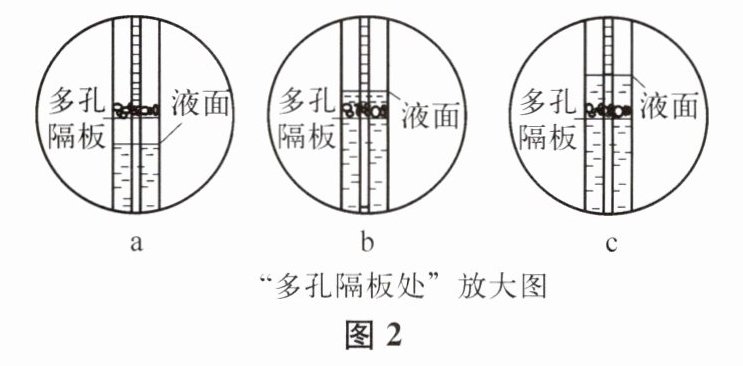
,该操作后,C中多孔隔板处依次观察到的现象如图2所示,则现象出现的顺序是cba
(用字母a、b、c排序)。(5)制取氢气也可用上述装置,实验室要制取氢气0.2g,至少需要3.65%的稀盐酸(密度为1.02g·mL⁻¹)的体积为多少?(计算结果保留一位小数)
答案:20.(1)锥形瓶 (2)下 (3)能 (4)可以控制反应的发生与停止 关闭活塞 cba (5)196.1 mL
解析:
(1)锥形瓶
(2)下
(3)能
(4)可以控制反应的发生与停止;关闭活塞;cba
(5)设至少需要$3.65\%$的稀盐酸的质量为$x$。
${Zn + 2HCl = ZnCl2 + H2↑}$
$73$ $2$
$3.65\%x$ $0.2\,\mathrm{g}$
$\frac{73}{2}=\frac{3.65\%x}{0.2\,\mathrm{g}}$
$x = 200\,\mathrm{g}$
体积$V=\frac{200\,\mathrm{g}}{1.02\,\mathrm{g·mL}^{-1}}\approx196.1\,\mathrm{mL}$
答:至少需要$3.65\%$的稀盐酸的体积为$196.1\,\mathrm{mL}$。
(2)下
(3)能
(4)可以控制反应的发生与停止;关闭活塞;cba
(5)设至少需要$3.65\%$的稀盐酸的质量为$x$。
${Zn + 2HCl = ZnCl2 + H2↑}$
$73$ $2$
$3.65\%x$ $0.2\,\mathrm{g}$
$\frac{73}{2}=\frac{3.65\%x}{0.2\,\mathrm{g}}$
$x = 200\,\mathrm{g}$
体积$V=\frac{200\,\mathrm{g}}{1.02\,\mathrm{g·mL}^{-1}}\approx196.1\,\mathrm{mL}$
答:至少需要$3.65\%$的稀盐酸的体积为$196.1\,\mathrm{mL}$。
21. (11分)对工厂烟气进行脱硫处理,可减少二氧化硫和硫化氢等污染。
Ⅰ. 用粉煤灰(主要含Al₂O₃、SiO₂等)制备碱式硫酸铝[Al₂(SO₄)ₓ(OH)ᵧ]溶液,可用于烟气脱硫,能有效减少二氧化硫的排放,其工艺流程如下图所示。
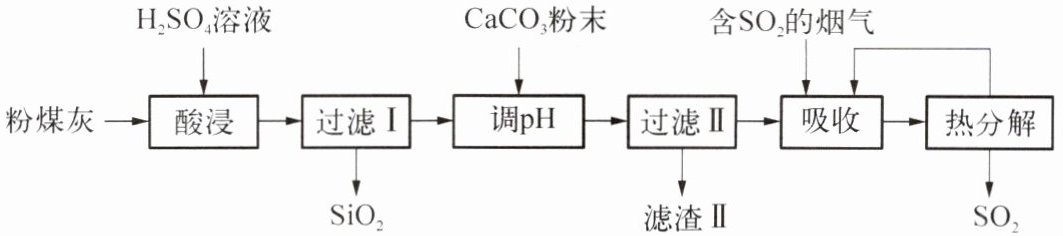
(1)根据化合物中各元素化合价代数和为0的规律可知,Al₂(SO₄)ₓ(OH)ᵧ中x和y的代数关系式为
(2)过滤Ⅰ中滤渣主要为SiO₂,说明SiO₂是一种
(3)酸浸时,Al₂O₃发生反应的化学方程式为
(4)调节pH约为3.6,目的是消耗溶液中过量的硫酸,滤渣Ⅱ的主要成分是
(5)若含SO₂的烟气中存在O₂,经完全热分解放出的SO₂量会小于吸收的SO₂量,且溶液酸性变强。其主要原因是
Ⅱ. H₂S气体常用氯化铁溶液循环脱硫工艺进行处理。其物质转化过程如右图所示。
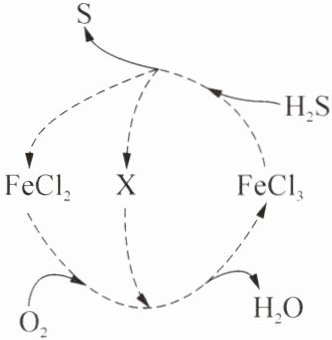
(6)由图可知,作为催化剂的FeCl₃
(7)X物质的化学式可能是
(8)写出该脱硫总反应的化学方程式:
Ⅰ. 用粉煤灰(主要含Al₂O₃、SiO₂等)制备碱式硫酸铝[Al₂(SO₄)ₓ(OH)ᵧ]溶液,可用于烟气脱硫,能有效减少二氧化硫的排放,其工艺流程如下图所示。

(1)根据化合物中各元素化合价代数和为0的规律可知,Al₂(SO₄)ₓ(OH)ᵧ中x和y的代数关系式为
$2x + y = 6$
。(2)过滤Ⅰ中滤渣主要为SiO₂,说明SiO₂是一种
难溶
(填“易溶”或“难溶”)于硫酸溶液的固体。(3)酸浸时,Al₂O₃发生反应的化学方程式为
$Al_2O_3 + 3H_2SO_4 = Al_2(SO_4)_3 + 3H_2O$
。(4)调节pH约为3.6,目的是消耗溶液中过量的硫酸,滤渣Ⅱ的主要成分是
硫酸钙(或$CaSO_4$)
。(5)若含SO₂的烟气中存在O₂,经完全热分解放出的SO₂量会小于吸收的SO₂量,且溶液酸性变强。其主要原因是
二氧化硫、氧气、水反应生成硫酸,硫酸受热不分解,导致放出二氧化硫的量减少,且硫酸解离出氢离子,导致溶液酸性变强
。Ⅱ. H₂S气体常用氯化铁溶液循环脱硫工艺进行处理。其物质转化过程如右图所示。

(6)由图可知,作为催化剂的FeCl₃
有
(填“有”或“没有”)参与反应过程。(7)X物质的化学式可能是
$HCl$
。(8)写出该脱硫总反应的化学方程式:
$2H_2S + O_2\xlongequal{FeCl_3}2H_2O + 2S\downarrow$
。答案:21.(1)$2x + y = 6$ (2)难溶 (3)$Al_2O_3 + 3H_2SO_4 = Al_2(SO_4)_3 + 3H_2O$ (4)硫酸钙(或$CaSO_4$) (5)二氧化硫、氧气、水反应生成硫酸,硫酸受热不分解,导致放出二氧化硫的量减少,且硫酸解离出氢离子,导致溶液酸性变强 (6)有 (7)$HCl$ (8)$2H_2S + O_2\xlongequal{FeCl_3}2H_2O + 2S\downarrow$