8. 向装有20g Fe₂O₃的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃管中剩余固体质量为15.2g,则下列说法正确的是(
A.该反应属于置换反应
B.反应生成Fe的质量为15.2g
C.参加反应的Fe₂O₃占原总质量的80%
D.反应生成CO₂的质量为16.5g
C
)A.该反应属于置换反应
B.反应生成Fe的质量为15.2g
C.参加反应的Fe₂O₃占原总质量的80%
D.反应生成CO₂的质量为16.5g
答案:8.C
解析:
设参加反应的${Fe2O3}$质量为$x$,生成${Fe}$的质量为$y$,生成${CO2}$的质量为$z$。
${Fe2O3 + 3CO\xlongequal{高温} 2Fe + 3CO2}$ 固体质量差
$160$ $112$ $132$ $160 - 112 = 48$
$x$ $y$ $z$ $20g - 15.2g = 4.8g$
$\frac{160}{48} = \frac{x}{4.8g}$,解得$x = 16g$。
$\frac{112}{48} = \frac{y}{4.8g}$,解得$y = 11.2g$。
$\frac{132}{48} = \frac{z}{4.8g}$,解得$z = 13.2g$。
A. 反应物为两种化合物,不属于置换反应,错误。
B. 生成${Fe}$质量为$11.2g$,错误。
C. 参加反应的${Fe2O3}$占原总质量:$\frac{16g}{20g} × 100\% = 80\%$,正确。
D. 生成${CO2}$质量为$13.2g$,错误。
答案:C
${Fe2O3 + 3CO\xlongequal{高温} 2Fe + 3CO2}$ 固体质量差
$160$ $112$ $132$ $160 - 112 = 48$
$x$ $y$ $z$ $20g - 15.2g = 4.8g$
$\frac{160}{48} = \frac{x}{4.8g}$,解得$x = 16g$。
$\frac{112}{48} = \frac{y}{4.8g}$,解得$y = 11.2g$。
$\frac{132}{48} = \frac{z}{4.8g}$,解得$z = 13.2g$。
A. 反应物为两种化合物,不属于置换反应,错误。
B. 生成${Fe}$质量为$11.2g$,错误。
C. 参加反应的${Fe2O3}$占原总质量:$\frac{16g}{20g} × 100\% = 80\%$,正确。
D. 生成${CO2}$质量为$13.2g$,错误。
答案:C
9. 一定条件下,下列物质在密闭容器内反应一段时间,测得反应前后各物质的质量关系如下表所示。下列叙述正确的是(
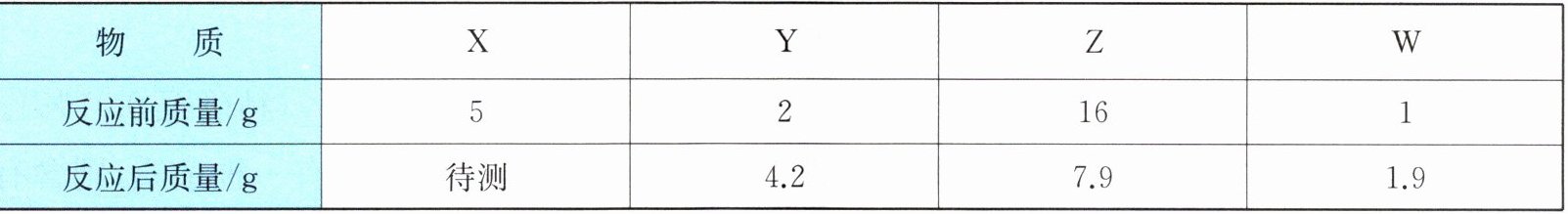
A.物质W是反应物
B.该反应可能伴随能量的变化
C.物质Z为化合物
D.该反应中X、Y的质量比为5∶2
C
)
A.物质W是反应物
B.该反应可能伴随能量的变化
C.物质Z为化合物
D.该反应中X、Y的质量比为5∶2
答案:9.C
解析:
解:根据质量守恒定律,反应前后总质量不变。
反应前总质量:$5 + 2 + 16 + 1 = 24\ \mathrm{g}$
反应后总质量:$\mathrm{待测} + 4.2 + 7.9 + 1.9 = 24\ \mathrm{g}$
解得:$\mathrm{待测} = 24 - 4.2 - 7.9 - 1.9 = 10\ \mathrm{g}$
各物质质量变化:
$X$:$10 - 5 = +5\ \mathrm{g}$(生成)
$Y$:$4.2 - 2 = +2.2\ \mathrm{g}$(生成)
$Z$:$7.9 - 16 = -8.1\ \mathrm{g}$(消耗)
$W$:$1.9 - 1 = +0.9\ \mathrm{g}$(生成)
反应可表示为:$Z \rightarrow X + Y + W$($Z$分解生成$X$、$Y$、$W$)
A. $W$质量增加,是生成物,A错误;
B. 化学反应一定伴随能量变化,B错误;
C. $Z$分解生成多种物质,为化合物,C正确;
D. $X$、$Y$质量比:$5:2.2 = 25:11\neq5:2$,D错误。
C
反应前总质量:$5 + 2 + 16 + 1 = 24\ \mathrm{g}$
反应后总质量:$\mathrm{待测} + 4.2 + 7.9 + 1.9 = 24\ \mathrm{g}$
解得:$\mathrm{待测} = 24 - 4.2 - 7.9 - 1.9 = 10\ \mathrm{g}$
各物质质量变化:
$X$:$10 - 5 = +5\ \mathrm{g}$(生成)
$Y$:$4.2 - 2 = +2.2\ \mathrm{g}$(生成)
$Z$:$7.9 - 16 = -8.1\ \mathrm{g}$(消耗)
$W$:$1.9 - 1 = +0.9\ \mathrm{g}$(生成)
反应可表示为:$Z \rightarrow X + Y + W$($Z$分解生成$X$、$Y$、$W$)
A. $W$质量增加,是生成物,A错误;
B. 化学反应一定伴随能量变化,B错误;
C. $Z$分解生成多种物质,为化合物,C正确;
D. $X$、$Y$质量比:$5:2.2 = 25:11\neq5:2$,D错误。
C
10. 一定量的甲烷(CH₄)在氧气中不完全燃烧,生成一氧化碳、二氧化碳和水的分子个数之比可能为(
A.2∶1∶6
B.1∶1∶2
C.2∶3∶6
D.3∶1∶6
A
)A.2∶1∶6
B.1∶1∶2
C.2∶3∶6
D.3∶1∶6
答案:10.A
解析:
设生成CO、CO₂、H₂O的分子个数分别为x、y、z。
根据碳元素守恒:x + y = n(CH₄)(n为甲烷分子数)。
根据氢元素守恒:2z = 4n(CH₄) → z = 2n(CH₄) → n(CH₄) = z/2。
则x + y = z/2 → z = 2(x + y)。
选项A:x=2,y=1,z=6。
z=2×(2+1)=6,满足z=2(x+y)。
选项B:x=1,y=1,z=2。
z=2×(1+1)=4≠2,不满足。
选项C:x=2,y=3,z=6。
z=2×(2+3)=10≠6,不满足。
选项D:x=3,y=1,z=6。
z=2×(3+1)=8≠6,不满足。
A
根据碳元素守恒:x + y = n(CH₄)(n为甲烷分子数)。
根据氢元素守恒:2z = 4n(CH₄) → z = 2n(CH₄) → n(CH₄) = z/2。
则x + y = z/2 → z = 2(x + y)。
选项A:x=2,y=1,z=6。
z=2×(2+1)=6,满足z=2(x+y)。
选项B:x=1,y=1,z=2。
z=2×(1+1)=4≠2,不满足。
选项C:x=2,y=3,z=6。
z=2×(2+3)=10≠6,不满足。
选项D:x=3,y=1,z=6。
z=2×(3+1)=8≠6,不满足。
A
11. 将65g锌样品(只含一种杂质)与足量盐酸反应,放出氢气2.1g。则锌样品中含有的杂质不可能是(
A.铜
B.铁
C.镁
D.铝
A
)A.铜
B.铁
C.镁
D.铝
答案:11.A
解析:
设65g纯锌与足量盐酸反应生成氢气的质量为x。
$Zn+2HCl=ZnCl_{2}+H_{2}\uparrow$
$65\quad\quad\quad\quad\quad\quad2$
$65g\quad\quad\quad\quad\quad\quad x$
$\frac{65}{2}=\frac{65g}{x}$
$x=2g$
因为2.1g>2g,所以杂质生成氢气的能力比锌强。
铜不与盐酸反应,生成氢气质量为0;铁、镁、铝与盐酸反应生成氢气的质量均大于同质量锌生成的氢气质量。
所以杂质不可能是铜。
A
$Zn+2HCl=ZnCl_{2}+H_{2}\uparrow$
$65\quad\quad\quad\quad\quad\quad2$
$65g\quad\quad\quad\quad\quad\quad x$
$\frac{65}{2}=\frac{65g}{x}$
$x=2g$
因为2.1g>2g,所以杂质生成氢气的能力比锌强。
铜不与盐酸反应,生成氢气质量为0;铁、镁、铝与盐酸反应生成氢气的质量均大于同质量锌生成的氢气质量。
所以杂质不可能是铜。
A
12. 20℃和60℃时,KCl的溶解度分别为34.0g和45.5g,下图为对KCl进行的溶解实验。下列分析错误的是(
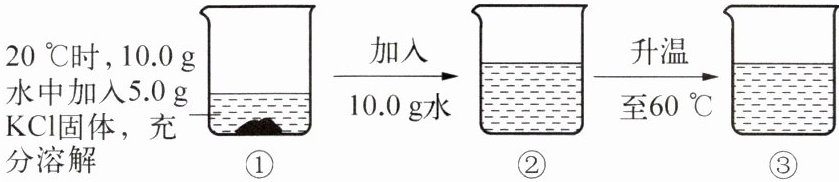
A.①中溶液为KCl的饱和溶液
B.②中溶液的质量为25.0g
C.溶液中溶质的质量:①<②=③
D.溶液中溶质的质量分数:①<②=③
D
)
A.①中溶液为KCl的饱和溶液
B.②中溶液的质量为25.0g
C.溶液中溶质的质量:①<②=③
D.溶液中溶质的质量分数:①<②=③
答案:12.D
解析:
解:20℃时,KCl溶解度为34.0g,即100g水最多溶解34.0g KCl。
①中10.0g水最多溶解KCl质量:$\frac{34.0g}{100g} × 10.0g = 3.4g$,加入5.0g KCl,有固体剩余,为饱和溶液,A正确。
②中加入10.0g水后总水质量20.0g,最多溶解KCl:$\frac{34.0g}{100g} × 20.0g = 6.8g$,5.0g KCl完全溶解,溶液质量=20.0g + 5.0g = 25.0g,B正确。
①中溶质质量3.4g,②中5.0g,60℃时KCl溶解度45.5g,20.0g水最多溶解$\frac{45.5g}{100g} × 20.0g = 9.1g$,③中溶质仍为5.0g,故溶质质量:①<②=③,C正确。
①中溶质质量分数:$\frac{3.4g}{10.0g + 3.4g} × 100\% \approx 25.4\%$;②中:$\frac{5.0g}{25.0g} × 100\% = 20\%$;③中:$\frac{5.0g}{25.0g} × 100\% = 20\%$,则①>②=③,D错误。
答案:D
①中10.0g水最多溶解KCl质量:$\frac{34.0g}{100g} × 10.0g = 3.4g$,加入5.0g KCl,有固体剩余,为饱和溶液,A正确。
②中加入10.0g水后总水质量20.0g,最多溶解KCl:$\frac{34.0g}{100g} × 20.0g = 6.8g$,5.0g KCl完全溶解,溶液质量=20.0g + 5.0g = 25.0g,B正确。
①中溶质质量3.4g,②中5.0g,60℃时KCl溶解度45.5g,20.0g水最多溶解$\frac{45.5g}{100g} × 20.0g = 9.1g$,③中溶质仍为5.0g,故溶质质量:①<②=③,C正确。
①中溶质质量分数:$\frac{3.4g}{10.0g + 3.4g} × 100\% \approx 25.4\%$;②中:$\frac{5.0g}{25.0g} × 100\% = 20\%$;③中:$\frac{5.0g}{25.0g} × 100\% = 20\%$,则①>②=③,D错误。
答案:D
13. 向100g溶质质量分数为4%的氢氧化钠溶液中逐滴加入氯化镁溶液,相关量的变化如右图所示。下列说法错误的是(
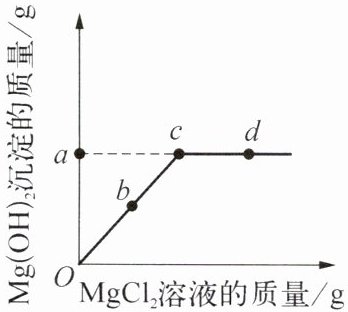
A.a点的值为2.9
B.b点对应的溶液能使无色酚酞溶液变红
C.c点时两者恰好完全反应
D.d点对应的溶液中含有三种溶质
D
)
A.a点的值为2.9
B.b点对应的溶液能使无色酚酞溶液变红
C.c点时两者恰好完全反应
D.d点对应的溶液中含有三种溶质
答案:13.D
解析:
解:100g溶质质量分数为4%的氢氧化钠溶液中含NaOH质量为:$100g×4\% = 4g$。
设生成$Mg(OH)_2$的质量为$x$,反应的化学方程式为:$2NaOH + MgCl_2 = Mg(OH)_2\downarrow+ 2NaCl$。
$\frac{80}{58}=\frac{4g}{x}$,解得$x = 2.9g$,故A正确。
b点时,$MgCl_2$未完全反应,溶液中仍有$NaOH$,能使无色酚酞变红,B正确。
c点后沉淀质量不再增加,说明此时两者恰好完全反应,C正确。
d点时,$MgCl_2$过量,溶液中溶质为$NaCl$和过量的$MgCl_2$,共两种溶质,D错误。
答案:D
设生成$Mg(OH)_2$的质量为$x$,反应的化学方程式为:$2NaOH + MgCl_2 = Mg(OH)_2\downarrow+ 2NaCl$。
$\frac{80}{58}=\frac{4g}{x}$,解得$x = 2.9g$,故A正确。
b点时,$MgCl_2$未完全反应,溶液中仍有$NaOH$,能使无色酚酞变红,B正确。
c点后沉淀质量不再增加,说明此时两者恰好完全反应,C正确。
d点时,$MgCl_2$过量,溶液中溶质为$NaCl$和过量的$MgCl_2$,共两种溶质,D错误。
答案:D
14. 将一定质量的铜与氢氧化铜的混合物在空气中加强热,完全反应后称得反应前后固体质量不变。则原混合物中铜与氢氧化铜的质量比是[已知:Cu(OH)₂ $\xlongequal{\triangle}$ CuO + H₂O](
A.36∶7
B.80∶98
C.64∶98
D.36∶49
D
)A.36∶7
B.80∶98
C.64∶98
D.36∶49
答案:14.D
解析:
设原混合物中铜的质量为$m$,氢氧化铜的质量为$n$。
铜在空气中加热反应:$2{Cu} + {O_2}\xlongequal{\triangle}2{CuO}$,固体质量增加量为参加反应的氧气质量。
参加反应的铜的物质的量为$\frac{m}{64}$,则生成氧化铜的物质的量为$\frac{m}{64}$,质量增加$\frac{m}{64}×16=\frac{m}{4}$。
氢氧化铜加热反应:${Cu(OH)_2}\xlongequal{\triangle}{CuO} + {H_2O}\uparrow$,固体质量减少量为生成水的质量。
氢氧化铜的物质的量为$\frac{n}{98}$,生成水的物质的量为$\frac{n}{98}$,质量减少$\frac{n}{98}×18=\frac{9n}{49}$。
由反应前后固体质量不变,得$\frac{m}{4}=\frac{9n}{49}$,解得$\frac{m}{n}=\frac{36}{49}$。
D
铜在空气中加热反应:$2{Cu} + {O_2}\xlongequal{\triangle}2{CuO}$,固体质量增加量为参加反应的氧气质量。
参加反应的铜的物质的量为$\frac{m}{64}$,则生成氧化铜的物质的量为$\frac{m}{64}$,质量增加$\frac{m}{64}×16=\frac{m}{4}$。
氢氧化铜加热反应:${Cu(OH)_2}\xlongequal{\triangle}{CuO} + {H_2O}\uparrow$,固体质量减少量为生成水的质量。
氢氧化铜的物质的量为$\frac{n}{98}$,生成水的物质的量为$\frac{n}{98}$,质量减少$\frac{n}{98}×18=\frac{9n}{49}$。
由反应前后固体质量不变,得$\frac{m}{4}=\frac{9n}{49}$,解得$\frac{m}{n}=\frac{36}{49}$。
D